Gjærsopp – resistensbestemmelse og resistensutvikling
Forfatter
seksjonsoverlege. Avdeling for bakteriologi, Statens institutt for folkehelse, Oslo, Norge
I løpet av senere år har man sett en økt forekomst av alvorlige soppinfeksjoner i mange land. Dette har ført til et økt forbruk av antimykotika, særlig azoler. Foreløpig har imidlertid resistensutvikling overfor antimykotika vært et lite problem. Utvikling av flukonazol resistens kan forekomme hos pasienter som behandles over lang tid (f. eks. aids-pasienter). Økt flukonazol forbruk kan også forårsake en endring i species fordeling fra flukonazolfølsomme species til species som enten er resistente (f.eks. Candida krusei) eller som har nedsatt følsomhet (f.eks. Candida glabrata). Det er viktig at resistenssituasjonen overvåkes.
I mange år var det relativt liten interesse for å utvikle metoder til resistensbestemmelse av gjær- og muggsopp. Årsaken til dette var først og fremst at soppinfeksjoner ble ansett for å være sjelden forekommende. I tillegg hadde man bare ett behandlingsalternativ, amfotericin B. I løpet av senere år har man imidlertid i mange land sett en kraftig økning i antall pasienter med alvorlige infeksjoner forårsaket av sopp (1 – 4). I noen større sykehus i USA utgjør f.eks. gjærsopp 10 – 15 % av alle positive blodkulturer hos sykehusinnlagte pasienter (5). Denne økningen av soppinfeksjoner har ført til økt bruk av antimykotika og også til utvikling av nye medikamenter, slik at man nå har alternativ til amfotericin B ved behandling av invasive mykoser. Det er særlig utviklingen av azoler (mikonazol, ketokonazol, flukonazol og itrakonazol) på slutten av 1980-årene og begynnelsen av 1990-årene som har betydd et stort fremskritt. Uheldigvis viste det seg at noen av azolene (mikonazol og ketokonazol) kan forårsake alvorlige bivirkninger hos et fåtall pasienter, og disse medikamentene benyttes derfor i liten grad. Itrakonazol og særlig flukonazol brukes imidlertid mye til behandling av både lokale og systemiske soppinfeksjoner.
På denne bakgrunn har det derfor blitt nødvendig å utvikle metoder til resistensbestemmelse også innen mykologien. Foreløpig har dette arbeidet i hovedsak vært konsentrert om gjærsopp.
Resistensbestemmelse
Alt for flere år siden var det noen laboratorier som hadde utviklet metoder til resistensbestemmelse av gjærsopp. Metodene var imidlertid ikke standardiserte og undersøkelser viste at det kunne være svært store variasjoner i resultatene når man sammenlignet ulike metoder (6). Resistensbestemmelse av gjærsopp er vanskelig fordi en rekke ulike faktorer kan influere på resultatet. Dette gjelder f.eks. valg av medium, tillaging av inokulat, inokulatets tetthet, inkubasjonstid, inkubasjonstemperatur og valg av kriterium for avlesning av endepunkt (7).
I de senere år har det vært utført et betydelig arbeid i regi av National Committee for Clinical Laboratory Standards (NCCLS) i USA for å komme frem til en standardisert referansemetode, slik at man kan sammenligne resultater oppnådd i ulike laboratorier. En buljongfortynningsmetode som enten kan utføres i rør eller i mikrotiterbrett ble relativt nylig godkjent som referansemetode (8). Med denne metoden lager man først en 2-fold fortynningsrekke av antimykotika i rør eller brønner i et mikrotiterbrett. Deretter inokuleres rørene (brønnene) med et standardisert gjærsopp- inokulat. Etter inkubasjon i 24 eller 48 timer finner man den minste konsentrasjonen av antimykotika som hemmer vekst av gjærsopp. Verdien for minste hemmende konsentrasjon (MIC) er uttrykk for soppstammens følsomhet for vedkommende medikament.
Resultatet av resistensbestemmelse med NCCLS-metoden kan imidlertid være vanskelig å avlese for noen medikamenter. Azoler kan ofte gi en gradvis hemming av soppens vekst over flere antimykotikakonsentrasjoner. Det er derfor nødvendig med relativt lang erfaring for å kunne bestemme MIC-verdien for enkelte Candida-stammer på en standardisert måte. I tillegg er NCCLS-metoden relativt arbeidskrevende. Den er derfor lite egnet for bruk i mindre laboratorier og det har følgelig vært arbeidet med å utvikle enklere metoder. Eksempler på dette er Etest (AB Biodisk, Sverige) og agardiffusjonsmetoden. Med Etest benyttes en plaststrimmel som inneholder en ferdiglaget fortynningsrekke av antimykotika. Denne legges på en agarskål inokulert med en gjærsoppstamme. Etter inkubasjon kan MIC avleses direkte fra en skala trykket på plaststrimmelen (Fig. 1). Med agardiffusjonsmetoden benyttes en tablett (eller filterpapirlapp) med et depot av antimykotikum. Tabletten legges på en agarskål inokulert med en gjærsoppstamme. Etter inkubasjon vil man få en sone rundt tabletten der gjærsoppstammen ikke vokser. Størrelsen på hemningssonen vil være et uttrykk for stammens følsomhet for medikamentet i tabletten (Fig. 2).
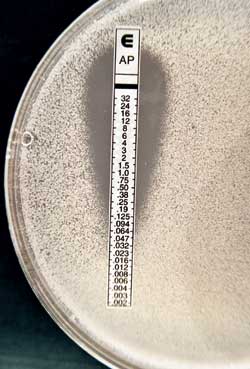
Fig. 1. Etest. Plaststrimmelen inneholder en ferdiglaget fortynningsrekke av amfotericin B. MIC-verdien avleses direkte på skalaen på plaststrimmelen.

Fig. 2. Agardiffusjonstesten. Hver tablett inneholder forskjellige antimykotika. Størrelsen på hemningssonen rundt tabletten er et mål på stammens følsomhet.
En rekke sammenlignende undersøkelser mellom NCCLS-metoden og Etest-metoden har vært utført. De fleste av disse studiene konkluderer med at Etest er et pålitelig alternativ til referansemetoden (9), men det er også noen undersøkelser som har vist en del avvik ved resistensbestemmelse overfor azoler (10). Ulempen med Etest er at den er relativt kostbar.
De aller fleste mikrobiologiske laboratorier i Skandinavia benytter allerede en agardiffusjonsmetode til resistensbestemmelse av bakterier og kjenner derfor denne metoden godt. Det ville derfor være en fordel dersom denne metoden også kunne benyttes til resistensbestemmelse av sopp. En slik test ble da også utviklet for nærmere 25 år siden og ser ut til å være i bruk i flere land i Europa (11, 12). Metoden har først og fremst vært evaluert for resistensbestemmelse overfor flukonazol (13 – 16). Undersøkelser, blant annet fra Norge, har vist at den er en god screeningundersøkelse for gjærsopp med nedsatt følsomhet (15, 16). Det er imidlertid et problem at man ikke kan skille mellom helt resistente stammer (MIC = 64 mg/ml) og stammer med moderat nedsatt følsomhet (MIC 16 – 32 mg/ml). I tillegg kan noen følsomme stammer bli angitt som resistente. Det er derfor nødvendig at stammer som har nedsatt følsomhet med agardiffusjonsmetoden undersøkes på nytt med en MIC-metode (16).
Klinisk korrelasjon
Resistensbestemmelse in vitro har klinisk nytteverdi bare hvis det er en sammenheng mellom resultatet av resistensbestemmelsen og behandlingsresultat in vivo. Imidlertid er det en rekke faktorer i tillegg til gjærsoppens in vitro-følsomhet som har stor betydning for behandlingsutfallet. Eksempler på dette er pasientens immunforsvar, underliggende sykdom, farmakokinetikk, medikamentinteraksjoner, den øvrige pasientbehandlingen osv. Det er derfor på ingen måte sikkert at antimykotisk behandling av en alvorlig infeksjon forårsaket av en soppstamme med lav MIC-verdi (en in vitro-følsom stamme) vil være vellykket. Dersom en pasient har en infeksjon forårsaket av en in vitro-resistent stamme bør imidlertid sjansen for behandlingssvikt være stor dersom medikamentet benyttes.
Fordi det nå er utviklet en referansemetode for resistensbestemmelse, har det også vært mulig å sammenholde resultatet av en rekke kliniske studier med siktemål å evaluere korrelasjon mellom resistensundersøkelse in vitro og behandlingsresultat in vivo. De fleste av disse undersøkelsene gjelder flukonazol og itrakonazol og oftest hos aids-pasienter med candidaøsofagitt eller ikke- nøytropene pasienter med fungemi. På grunnlag av slike studier har NCCLS nå kommet med forslag til MIC brytningspunkter for disse to medikamentene (Tabell 1) (17). Når det gjelder amfotericin B, foreligger det langt færre undersøkelser. Årsaken til dette er trolig at resistens forekommer sjelden, men det kan også se ut til at NCCLS-buljongfortynningsmetoden er mindre egnet til resistensbestemmelse overfor dette medikamentet (18).
Minste hemmende konsentrasjon, g/ml |
|||
|---|---|---|---|
Antimykotika |
Følsom |
Følsom dose-avhengig# eller intermediær |
Resistent |
Flukonazol (17) |
< 8 |
16 – 32 |
> 32 |
Itrakonazol (17) |
< 0,125 |
0,25 – 0,5 |
> 0,5 |
Flucytosin (35) |
< 4 |
Intermediær: 8 – 16 |
> 16 |
Amfotericin B (18) |
< 1 |
> 1 |
|
Resistensforhold
Det er i dag to medikamenter, amfotericin B og flukonazol, som anbefales til behandling av alvorlige soppinfeksjoner (19). I tillegg kan flucytosin i visse situasjoner anvendes sammen med amfotericin B.
Amfotericin B har vært det viktigste medikamentet til behandling av alvorlige soppinfeksjoner i over 40 år. Forbruket i Norge er imidlertid lavt. Grunnen til dette er ganske sikkert at medikamentet ofte kan forårsake alvorlige bivirkninger og derfor kun benyttes på strenge indikasjoner. Resistens overfor amfotericin B har svært sjelden vært rapportert. Noe av årsaken til dette kan imidlertid være metodologiske problemer forbundet med resistensbestemmelse overfor amfotericin B (18). I en nylig publisert oversiktsartikkel over amfotericin B-resistens (20) ble det kun referert til 26 publikasjoner med i alt 44 pasienter. Resistensutvikling ser derfor ikke ut til å være et problem av betydning. Man regner med at de aller fleste gjærsopparter, med unntak av noen få og sjelden forekommende species, er følsomme overfor amfotericin B.
Flucytosin benyttes lite til behandling av alvorlige soppinfeksjoner. Resistens overfor dette medikamentet kan utvikles raskt og flucytosin skal derfor alltid gis i kombinasjon med et annet medikament (amfotericin B). Av 506 Candida blodkulturisolat fra Norge i perioden 1991 – 1996 hadde 27 (5 %) stammer nedsatt følsomhet (MIC = 8 g/ml) for flucytosin (Tabell 2). I en undersøkelse fra Sverige har man funnet liknende resultat. Av 232 blodkulturisolat fra 15 svenske sykehus i perioden 1994 – 1998 hadde 11 (5 %) stammer nedsatt flucytosin-følsomhet (21).
Antimykotika |
Resistensforhold |
|---|---|
Amfotericin B |
Candidemi-isolat (506 stammer): Alle isolat følsomme.I følge litteraturen kan C. lusitaniae-stammer være resistente, men denne arten er sjeldent årsak til infeksjon i Norge. |
Flucytosin |
Candidemi-isolat (506 stammer): De fleste isolat er følsomme. Andel stammer med nedsatt følsomhet var under 1 % i 1991 og 1992, 8,9 % i 1993, 5,4 % i 1994, 9,2 % i 1995 og 5,2 % i 1996. Alle C. krusei-stammer hadde MIC = 16 g/ml mens 3 % av C. albicans, C. glabrata og C. tropicalis-stammer hadde nedsatt følsomhet med MIC = 8 g/ml. |
Flukonazol |
Klinisk viktige isolat fra 1991 – 1999 (1407 stammer): Vel 14 % av stammene hadde nedsatt følsomhet (følsom dose-avhengig 8,7 %, resistent 5,5 %). C. albicans (992 stammer): Følsom 97 %, følsom dose-avhengig 2 %, resistent 1 %. Stammer med nedsatt følsomhet var isolert fra aids-pasienter eller fra andre pasienter som hadde vært behandlet over svært lang tid.C. parapsilosis (76 stammer): Følsom 99 %, følsom dose-avhengig 1 %, resistent 0 %.C. tropicalis (105 stammer): Følsom 97 %, følsom dose-avhengig 2 %, resistent 1 %.C. glabrata (142 stammer): Følsom 33 %, følsom dose-avhengig 48 %, resistent 19 %.C. krusei og C. norvegensis: Alle isolat skal betraktes som resistente uavhengig av in vitro-resultat. |
Flukonazol har lite bivirkninger og har vist seg likeverdig med amfotericin B til behandling av infeksjoner forårsaket av følsomme stammer hos ikke-neutropene pasienter (22). Preparatet benyttes derfor mye både til behandling av lokale og invasive gjærsoppinfeksjoner. De aller fleste gjærsopparter er følsomme overfor flukonazol, men det er imidlertid noen viktige unntak. Alle isolat som tilhører artene Candida krusei og Candida norvegensis vil for eksempel være resistente uansett tidligere eksponering for medikamentet. I tillegg har en stor andel av en tredje Candida-art, Candida glabrata, nedsatt følsomhet overfor flukonazol med MIC-verdier over 4 – 8 mg/ml (23, 24). Infeksjoner forårsaket av slike stammer vil være vanskelig å behandle med vanlige doser (17).
Den hyppigst forekommende Candida-arten, Candida albicans, er følsom for flukonazol, men denne arten kan imidlertid utvikle resistens som et resultat av genetiske mutasjoner (26). Resistensutvikling overfor azoler ble beskrevet allerede på begynnelsen av 1980-årene. Antall rapporter var imidlertid svært få og gjaldt stort sett pasienter med mukokutan candidiasis som hadde vært behandlet med mikonazol eller ketokonazol over lang tid (27). I de fleste land ble flukonazol registrert til bruk på begynnelsen av 1990-årene. Dette sammenfalt med et økende antall pasienter med aids med behandlingstrengende oral candidiasis og candidaøsofagitt. Disse pasientene ble ofte gitt flukonazoltabletter til selvbehandling over kortere eller lengre tid for å kurere symptomgivende infeksjoner i hals- og spiserør. Infeksjonen var residiverende og mange pasienter hadde derfor et relativt stort flukonazolforbruk. Det tok ikke lang tid før det kom rapporter om resistensutvikling overfor flukonazol hos C. albicans-isolat (15,28,29). De fleste av disse pasientene hadde benyttet medikamentet over lang tid. Det har etter hvert blitt utført mye arbeid for å avklare de genetiske mekanismene som fører til resistens overfor azoler (26). Flere ulike mekanismer er beskrevet. Noen av disse vil forårsake resistens overfor et enkelt azol, mens andre vil forårsake kryssresistens overfor flere medikamenter. Azolresistens kan utvikles gradvis over tid og ulike kombinasjoner av resistensmekanismer kan være tilstede i et klinisk isolat (26,30).
Hos aids-pasienter har utvikling av flukonazolresistente C. albicans-stammer vært et problem. Foreløpig ser det imidlertid ut til at det er en svært lav forekomst av resistente C. albicans-stammer hos andre pasientgrupper (Tabell 2). Årsaken til dette er trolig at de fleste pasienter behandles over kort tid slik at resistensutvikling ikke finner sted.
Undersøkelser av Candida-arter isolert fra blodkultur i Danmark, Norge og Sverige har bekreftet at den hyppigst forekommende arten, C. albicans, i regelen er følsom for fluconazol, mens C. glabrata oftest har nedsatt følsomhet (Tabell 3) (21, 24, 31).
Andel ( %) av stammer som er: |
|||||
|---|---|---|---|---|---|
Species |
Land |
Antall stammer |
Følsom |
Følsom dose-avhengig# |
Resistent |
C. albicans |
Danmark |
92 |
96 |
0 |
4 |
Norge |
336 |
100 |
0 |
0 |
|
Sverige |
123 |
100 |
0 |
0 |
|
C. glabrata |
Danmark |
12 |
0 |
92 |
8 |
Norge |
66 |
36 |
50 |
14 |
|
Sverige |
51 |
4 |
55 |
41 |
|
Andre Candida spp.* |
Danmark |
10 |
80 |
0 |
20 |
Norge |
104 |
80 |
5 |
15 |
|
Sverige |
58 |
76 |
0 |
24 |
|
Alle species |
Danmark |
114 |
84 |
10 |
6 |
Norge |
506 |
88 |
8 |
5 |
|
Sverige |
232 |
73 |
12 |
15 |
|
Det har også vært bekymring for at økt flukonazolbruk skal føre til et seleksjonspress med økt forekomst av non-albicans-arter med nedsatt følsomhet. Endringer kan sikkert forekomme i sykehus der flukonazol brukes mye til profylakse og behandling (32). Det er imidlertid mange faktorer som kan ha betydning for hvilke Candida-arter som dominerer på hvert enkelt sykehus. Det kan blant annen være betydelige forskjeller fra land til land når det gjelder forekomst av ulike gjærsopparter. I USA er f. eks. C. albicans-andelen av isolat fra blodkultur omkring 50 %, mens man i Norge og Finland finner at ca. 65 – 70 % av candidemi-isolatene utgjøres av C. albicans (24, 25). I USA ser det ut til at det har skjedd en endring i fordelingen av non-albicans-artene isolert fra blod i og med at forekomsten av Candida tropicalis har gått ned og C. glabrata har økt de senere år (4). I en studie fra fem universitetssykehus i Nederland fant man også en økning av C. glabrata-forekomsten fra 6,8 % i 1987 til 14,8 % i 1995 (33). Årsaken til slike endringer er ikke klarlagt. Ved andre sykehus har speciesfordeling vært uendret gjennom lang tid. På Rigshospitalet i København var det for eksempel ingen forskjell i fordeling av Candida-species isolert fra blodkultur fra 1984 til 1994 (33). Speciesfordelingen var også omtrent den samme i norske sykehus i perioden 1991 til 1999 (34). Forekomsten av C. glabrata i Norge har vært forholdsvis høy (13 – 14 %) både før og etter at flukonazol ble introdusert på markedet.
Fordi antall medikamenter til behandling av alvorlige mykoser er svært begrenset, vil en økning i resistens kunne få alvorlige konsekvenser. Det er derfor viktig at resistenssituasjonen i Skandinavia overvåkes for å oppdage eventuelle endringer. Dersom resistens skulle bli et problem, vil det være viktig å endre behandlingsrutiner for om mulig å snu en slik utvikling.
I Norge har man fra 1991 systematisk overvåket resistensforholdene for gjærsopp isolert fra blodkultur og andre viktige isolat. Alle de mikrobiologiske laboratoriene i landet sender slike isolat til identifisering og resistensbestemmelse ved mykologisk laboratorium på Statens institutt for folkehelse. De viktigste resultat av denne overvåkningen er gjengitt i Tabell 2.
Konklusjon
Utvikling av resistens mot antimykotika har foreløpig vært et lite problem når det gjelder gjærsopp. Dersom nye azoler gis over lang tid, kan det oppstå genetiske mutasjoner som fører til resistens. Det er også en fare for at et økt totalforbruk av azoler kan føre til en seleksjon av azolresistente species.
Fordi antall medikamenter til behandling av alvorlige mykoser er svært begrenset, vil en økning i resistens kunne få alvorlige konsekvenser. Det er derfor viktig at resistenssituasjonen i Skandinavia overvåkes for å oppdage eventuelle endringer.
De fleste gjærsopparter har foreløpig et forutsigbart resistensmønster overfor de viktigste antimykotika (Tabell 2 og 3). En identifikasjon til speciesnivå vil derfor gi et godt holdepunkt for valg av medikament.
Fordi soppbehandling ofte startes på empirisk grunnlag vil en samlet oversikt over hvilke arter som vanligvis forårsaker alvorlige soppinfeksjoner på et sykehus være nyttig ved valg av medikament.
English summary
Sandven P.
Antifungal susceptibility testing of yeasts
116 – 20
In recent years there has been an increase in serious fungal infections in many countries. The use of antifungal agents, especially fluconazole, has increased in parallel with the increased recognition of yeasts as important pathogens. Development of resistance to antifungal agents has so far been a small problem. Resistance to fluconazole has, however, occurred in many patients (e.g. AIDS patients) that have been treated for a prolonged period of time. There is also a danger that increased fluconazole use will exert a selective pressure causing a shift in species distribution from fluconazole-susceptible species to resistant species (e.g. Candida krusei) or species with decreased susceptibility (e.g. Candida glabrata). It is important that the resistance situation is monitored in each country.
Referanser
1. Beck Sague C, Jarvis WR. Secular trends in the epidemiology of nosocomial fungal infections in the United States, 1980 – 1990. J Infect Dis 1993; 167(5): 1247 – 51.
2. Chakrabarti A, Ghosh A, Batra R, Kaushal A, Roy P, Singh H. Antifungal susceptibility pattern of non-albicans Candida species & distribution of species isolated from candidaemia cases over a 5 year period. Indian J Med Res 1996; 104: 171 – 6.
3. Hung CC, Chen YC, Chang SC, Luh KT, Hsieh WC. Nosocomial candidemia in a university hospital in Taiwan. J Formos Med Assoc 1996; 95 (1): 19 – 28.
4. Sandven P. Epidemiology of candidemia. Rev Iberoam Micol 2000; 17: 73 – 81.
5. Wenzel RP. Nosocomial candidemia: risk factors and attributable mortality. Clin Infect Dis 1995; 20 (6): 1531 – 4.
6. Galgiani JN, Reiser J, Brass C, Espinel Ingroff A, Gordon MA, Kerkering TM. Comparison of relative susceptibilities of Candida species to three antifungal agents as determined by unstandardized methods. Antimicrob Agents Chemother 1987; 31: 1343 – 7.
7. Galgiani JN. Susceptibility testing of fungi: current status of the standardization process. Antimicrob Agents Chemother 1993; 37: 2517 – 21.
8. National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved standard M27-A. Wayne, Pa: National Committee for Clinical Laboratory Standards; 1997.
9. Pfaller MA, Messer SA, Karlsson A, Bolmstrom A. Evaluation of the Etest method for determining fluconazole susceptibilities of 402 clinical yeast isolates by using three different agar media. J Clin Microbiol 1998; 36(9): 2586 – 9.
10. Warnock DW, Johnson EM, Rogers TR. Multi-centre evaluation of the Etest method for antifungal drug susceptibility testing of Candida spp. and Cryptococcus neoformans. BSAC Working Party on Antifungal Chemotherapy. J Antimicrob Chemother 1998; 42 (3): 321 – 31.
11. Bille J, Glauser MP. Evaluation of the susceptibility of pathogenic Candida species to fluconazole. Eur J Clin Microbiol Infect Dis 1997; 16 (12): 924 – 8.
12. Schmalreck AF, Kottmann I. Empfindlichkeitsprufung von Hefen gegenüber Fluconazol: Vorschlag für eine standardisierte Agardiffusions- Methode mit 25-microgram-Fluconazol- Testblattchen. Mycoses 1996; 39 (Suppl 2): 27 – 30.
13. Barry AL, Brown SD. Fluconazole disk diffusion procedure for determining susceptibility of Candida species. J Clin Microbiol 1996; 34 (9): 2154 – 7.
14. May JL, King A, Warren CA. Fluconazole disc diffusion testing for the routine laboratory. J Antimicrob Chemother 1997; 40 (4): 511 – 6.
15. Sandven P, Bjørneklett A, Maeland A. Susceptibilities of Norwegian Candida albicans strains to fluconazole: emergence of resistance. Antimicrob Agents Chemother 1993; 37 (11): 2443 – 8.
16. Sandven P. Detection of fluconazole-resistant Candida strains by a disc diffusion screening test. J Clin Microbiol 1999; 37 (12): 3856 – 9.
17. Rex JH, Pfaller MA, Galgiani JN, Bartlett MS, Espinel-Ingroff A, Ghannoum MA, et al. Development of interpretive breakpoints for antifungal susceptibility testing: conceptual framework and analysis of in vitro–in vivo correlation data for fluconazole, itraconazole, and candida infections. Clin Infect Dis 1997; 24 (2): 235 – 47.
18. Collin B, Clancy CJ, Nguyen MH. Antifungal resistance in non-albicans Candida species. Drug Resist Updates 1999; 2: 9 – 14.
19. Edwards JE Jr, Bodey GP, Bowden RA, Buchner T, de Pauw BE, Filler SG, et al. International conference for the development of a consensus on the management and prevention of severe candidal infections. Clin Infect Dis 1997; 25 (1): 43 – 59.
20. Sterling TR, Merz WG. Resistance to amphotericin B: emerging clinical and microbiological patterns. Drug Resist Updates 1998; 1: 161 – 5.
21. Chryssanthou E. Unchanged antifungal susceptibility patterns of Swedish Candida sp. blood isolates between 1994 and 1998. Rev Iberoam Micol 2000; 17: 159.
22. Rex JH, Bennett JE, Sugar AM, Pappas PG, van der Horst CM, Edwards JE, et al. A randomized trial comparing fluconazole with amphotericin B for the treatment of candidemia in patients without neutropenia. N Engl J Med 1994; 331 (20): 1325 – 30.
23. Pfaller MA, Jones RN, Doern GV, Sader HS, Messer SA, Houston A, et al. Bloodstream infections due to Candida species: SENTRY antimicrobial surveillance program in North America and Latin America, 1997 – 1998. Antimicrob Agents Chemother 2000; 44 (3): 747 – 51.
24. Sandven P, Bevanger L, Digranes A, Gaustad P, Haukland HH, Steinbakk M. Constant low rate of fungemia in Norway, 1991 to 1996. J Clin Microbiol 1998; 36 (12): 3455 – 9.
25. Poikonen E, Lyytikäinen O, Ruutu P. Population-based candidemia surveillance in Finland, 1995 – 1999. Abstact 267. In: Program and abstracts of the 41st Interscience Conference on Antimicrobial Agents and Chemotherapy. Washington DC: American Society for Microbiology; 2001.
26. Sanglard D, Ischer F, Calabrese D, Micheli M, Bille J. Multiple resistance mechanisms to azole antifungals in yeast clinical isolates. Drug Resist Updates 1998; 1: 255 – 65.
27. Horsburgh CR Jr, Kirkpatrick CH. Long-term therapy of chronic mucocutaneous candidiasis with ketoconazole: experience with twenty-one patients. Am J Med 1983; 74 (1B): 23 – 9.
28. Chryssanthou E, Torssander J, Petrini B. Oral Candida albicans isolates with reduced susceptibility to fluconazole in Swedish HIV-infected patients. Scand J Infect Dis 1995; 27: 391 – 5.
29. Fox R, Neal KR, Leen CL, Ellis ME, Mandal BK. Fluconazole resistant Candida in AIDS [letter]. J Infect 1991; 22 (2): 201 – 4.
30. Franz R, Kelly SL, Lamb DC, Kelly DE, Ruhnke M, Morschhauser J. Multiple molecular mechanisms contribute to a stepwise development of fluconazole resistance in clinical Candida albicans strains. Antimicrob Agents Chemother 1998; 42 (12): 3065 – 72.
31. Arendrup M, Lundgren B, Jensen IM, Hansen BS, Frimodt-Møller N. Comparison of Etest and tablet diffusion test with NCCLS broth microdilution method for fluconazole and amphotericin B susceptibility of Candida isolates. J Antimicrob Chemother 2001; 47 (5): 521 – 6.
32. Abi-Said D, Anaissie E, Uzun O, Raad I, Pinzcowski H, Vartivarian S. The epidemiology of hematogenous candidiasis caused by different Candida species. Clin Infect Dis 1997; 24 (6): 1122 – 8.
33. Voss A, Kluytmans JA, Koeleman JG, Spanjaard L, Vandenbroucke Grauls CM, Verbrugh HA, et al. Occurrence of yeast bloodstream infections between 1987 and 1995 in five Dutch university hospitals. Eur J Clin Microbiol Infect Dis 1996; 15 (12): 909 – 12.
34. Bruun B, Westh H, Stenderup J. Fungemia: An increasing problem in a Danish university hospital 1989 to 1994. J Clin Microbiol Infect 1995; 1 (2): 124 – 6.
35. Rex JH, Walsh TJ, Sobel JD, Filler SG, Pappas PG, Dismukes WE, et al. Practice guidelines for the treatment of candidiasis. Clin Infect Dis 2000; 30 (4): 662 – 78.
Nøkkelord: Behandling; Infeksjon; Legemiddel; Mikrobiologi
Adresse: Per Sandven, Avdeling for bakteriologi, Statens institutt for folkehelse, Postboks 4404 Nydalen, N-0403 Oslo, Norge.
E-post: per.sandven@folkehelsa.no