Antibiotikainduserte superinfeksjoner
Uttrykket superinfeksjon brukes når mikrobiologiske og kliniske funn indikerer at en sekundær infeksjon har utviklet seg i tilknytning til en primær infeksjon. Ofte vil årsaken være antibiotikabehandling som fører til endringer i den mikrobielle økologi. Derved bortfaller den inhibitoriske effekten som mange medlemmer av normalfloraen i munnhule/svelg og andre kroppsåpninger og i tarm har på sykdomsfremkallende mikrober. Typiske eksempler på superinfeksjon er candidose, pseudomembranøs kolitt og enteritt. I denne artikkelen blir kliniske, mikrobiologiske og terapeutiske sider ved superinfeksjoner i munnslimhinne og periodontium omtalt.
Antibiotikainduserte superinfeksjoner inntrer vanligvis 3 – 6 dager etter behandlingsstart. I enkelte tilfeller kan de opptre 2 – 8 uker etterpå. Den anslåtte frekvensen av superinfeksjon hos pasienter på antibiotikabehandling varierer sterkt: mellom 0,6 % og 20 % (1, 2). En betydelig del erverves i sykehus. Mange mikroorganismer som under normale forhold ikke er patogene, kan gi alvorlige antibiotikainduserte superinfeksjoner. Typiske eksempler er oral candidose, pseudomembranøs kolitt utløst av Clostridium difficile og stafylokokkenteritt. En rekke gramnegative stavbakterier kan også gi superinfeksjon.
Økologiske forandringer som følge av antibiotikabehandling
Når munnhulens mikroflora er etablert, er den vanligvis relativt stabil. En rekke faktorer kan influere på veksten av mikrober i munnhulen. Antibiotika er blant de med størst påvirkningskraft. De vil kunne gi økologiske forandringer i normalfloraen på hud og slimhinner, inklusive munnhule og tarm, med overvekst av potensielt patogene organismer (3 – 6). Antibiotikabehandling resulterer i bortfall av den koloniseringsresistens som normalfloraen representerer, eller den selekterer for resistente mikrober. Disse kan spre seg innen pasienter og mellom disse og forårsake infeksjoner.
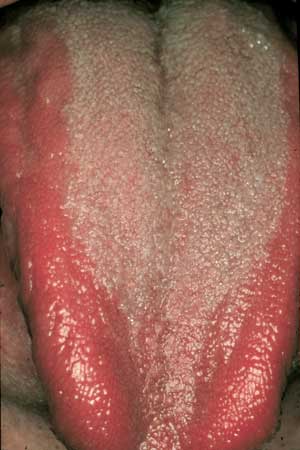
Fig. 1. Erytematøs candidose på tungen («antibiotic sore tongue») med intens svie hos en 37-årig mann behandlet med antibakterielle antibiotika for urinveisinfeksjon. Også kinnslimhinnen var affisert. Symptomfrihet etter avsluttet antibiotikaterapi. (Gjengitt med tillatelse fra T Axéll og Förlagshuset Gothia.)
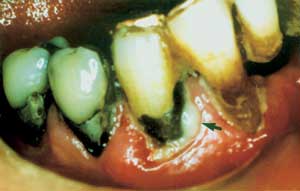
Fig. 2 – 3. Purulente periodontale superinfeksjoner etter antibakteriell antibiotikabehandling.
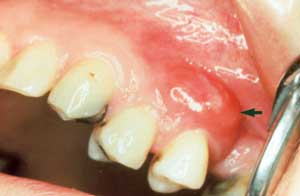
Fig. 3.
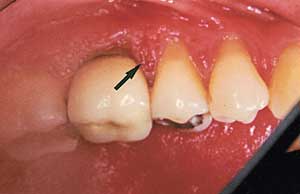
Fig. 4. Ulcerativ periodontal superinfeksjon etter antibakteriell antibiotikaterapi.
Redusert mengde |
Økt mengde |
|---|---|
Gramnegative fakultative kokker |
Koagulasepositive stafylokokker |
Gramnegative anaerobe staver |
Alfahemolytiske streptokokker |
Koagulasenegative stafylokokker |
Betahemolytiske streptokokker |
Grampositive anaerobe kokker (penicillin) |
|
Sopp (penicillin) |
Mukosale superinfeksjoner
Det er velkjent at behandling med antibakterielle antibiotika øker forekomsten av gjærsopp i munnhulen. Langvarig terapi med slike antibiotika i store doser eller med flere antibiotika samtidig øker risikoen for opportunistiske infeksjoner, herunder soppinfeksjoner. Antibiotikabehandling er vist å øke forekomsten av akutt pseudomembranøs candidose (trøske). Også akutt erytematøs candidose kan forekomme (Fig. 1). Antibiotikastomatitt opptrer oftest etter bruk av bredspektrede antibiotika, spesielt tetracyklin lokalt i munnhulen. Hele munnslimhinnen kan være rød, ødematøs og sår (7). Også flekker med trøske kan påvises i beskyttede områder slik som i bakre del av overgangsfolden i overkjeven. Angulær stomatitt kan også manifestere seg. Mens lokaliserte mykoser har god prognose, kan systemiske soppinfeksjoner ende fatalt.
Periodontale superinfeksjoner
Finske arbeider
I Finland har periodontale superinfeksjoner vært gjenstand for kliniske, mikrobiologiske og terapeutiske undersøkelser (8 – 11). Det ble påvist slike infeksjoner hos 5 – 30 % av personer med egne tenner som får antibiotikabehandling. Høyest frekvens ble funnet i aldersgruppen 40 – 49 år, som også hadde mest periodontitt. Samtidig med at akutt purulent infeksjon (Fig. 2 og 3) manifesterte seg, økte plakkindeks, gingivalindeks, lommedybde og tannmobilitet. Ulcerasjon (Fig. 4) utviklet seg i tilsynelatende klinisk frisk gingiva. Penicillin var det antibiotikum som oftest ga periodontal superinfeksjon. Bruk av ytterligere antibiotika forverret situasjonen. Penicillin og erytromycin hadde ulike effekter på mikrofloraen (Tabell 1). De kliniske og mikrobiologiske forandringene opphørte i løpet av 12 uker etter seponering.
Amerikanske arbeider
Etter mekanisk depuration og systemisk behandling med doksycyklin (20 mg første dag, deretter 100 mg/dag i 20 dager) ble det blant 21 amerikanske pasienter med voksen periodontitt påvist mer enn en 10-foldig økning i mengden av stafylokokker (11 pasienter), Candida albicans (2 pasienter), Enterobacter aerogenes (2 pasienter) og Escherichia coli (1 pasient) i subgingivalt plakk (12).
Enterokokker (Enterococcus faecalis) er også i en annen amerikansk studie vist å være hyppig involvert i superinfeksjon og kan bidra til nedbrytning av periodontalt støttevev (13). Disse enterokokkene var resistente overfor terapeutiske nivåer av penicillin G, tetracyklin og metronidazol, men relativt følsomme overfor ciprofloxacin og amoxicillin/ kalium klavulansyre (Augmentin®).
Nyere betalaktamantibiotika og superinfeksjoner
I en litteraturoversikt over nyere betalaktamantibiotika ble det rapportert at bruk av moxalactam kan gi både gramnegative (5 – 38 %) og enterokokkale (2 – 12 %) superinfeksjoner (14). Ceftazidim og moxalactam er oftere forbundet med anaerobe superinfeksjoner, vanligvis forårsaket av Clostridium-arter, enn andre betalaktamantibiotika. Sammenlignbare eller lavere frekvenser av superinfeksjon er rapportert ved bruk av cefoperazon, ceftazidim, mezlocillin og imipenem. De vanligst utløsende agens for disse superinfeksjonene er Candida, Pseudomonas og betalaktamaseproduserende medlemmer av familien Enterobacteriaceae. Enkelte av disse superinfeksjonene synes å være nærmest uunngåelige, f. eks. de som opptrer i intensivavdelinger når nye betalaktamantibiotika benyttes. Enkelte systemiske superinfeksjoner, f. eks. infeksjoner utløst av Candida, kan ende fatalt (15).
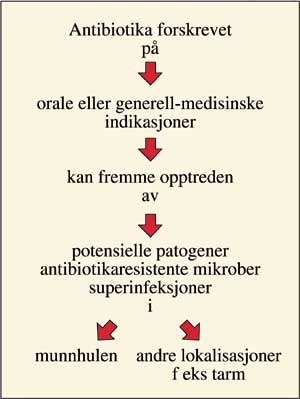
Fig. 5. Forskrivning av antibiotika mot oral infeksjon av tannlege eller på generell-medisinsk grunnlag av lege innebærer risiko for superinfeksjoner i munnhulen og lokalisasjoner utenfor denne.
Antibiotikaprofylakse og superinfeksjoner
I en undersøkelse av ortognatisk kirurgi ble to profylaktiske penicillinregimer evaluert hos 18 pasienter (16). Alle pasientene fikk benzylpenicillin som infusjon ved begynnelsen av operasjonen og deretter hver 6. time. Sju av de 9 pasientene som fikk penicillin i bare én dag, viste uttalt reduksjon i mengden av streptokokker og meningokokker. I de 9 pasientene som fikk en ukes penicillinbehandling etter inngrepet, var kolonisering med enterokokker, enterobakterier og gjærsopp uttalt.
I en undersøkelse av abdominal kirurgi hos 220 pasienter fikk én gruppe pasienter cefalosporin preoperativt + 5 døgn placebo, en annen gruppe cefalosporin preoperativt + 5 døgn cefalosporin (17). I en tredje gruppe fikk 451 av 1624 pasienter 5 – 7 døgns cefalosporinkur med start etter at peritoneal kontaminasjon hadde funnet sted. Kun profylaktisk bruk av antibiotika reduserte hyppigheten av sår- og peritoneale infeksjoner.
Utvidelse av den postoperative antibiotikadekningen til en uke så altså ikke ut til å ha noen gunstig tilleggseffekt. Tvert om, den var uheldig på grunn av de økologiske endringene den avstedkom (18).
Subinhibitorisk antibiotikabehandling og superinfeksjoner
Fire pasientgrupper ble evaluert i en dobbelt blindundersøkelse med mekanisk scaling og rotplaning og/eller 20 mg doksycyklin 2 x daglig (Periostat®) i 9 måneder. Doksycyklin ga ikke overvekst av mikroorganismer, inklusive opportunister, eller endringer i deres følsomhet overfor stoffet (19). Andre undersøkelser har gitt tilsvarende resultater. Ulike regimer med subinhibitoriske mengder av tetracyklin ser ut til å redusere kollagenaseaktiviteten i gingivalvæsken hos voksne med periodontitt uten at dette fører til resistensutvikling eller forskyvninger i mikrofloraen.
Avsluttende betraktninger
Superinfeksjoner kan bidra til at sykdommen forlenges eller forverres eller ender fatalt. De skyldes ofte mikrober som det er vanskelig å utrydde, f. eks. arter innen Candida, Enterobacteriaceae og Pseudomonas. Superinfeksjoner kan opptre i andre lokalisasjoner enn de medikasjonen opprinnelig var rettet mot. Dette innebærer at tannlegen kan utløse slike infeksjoner utenfor sitt arbeidsfelt, og at leger ved behandling av ekstraoral infeksjon kan forårsake superinfeksjoner i munnhulen (Fig. 5).
Superinfeksjoner kan spres innen og mellom pasienter. De opptrer hyppigere ved bruk av bredspektrede antibiotika enn ved smalspektrede. Sistnevnte er å foretrekke. Vi skal imidlertid ikke avholde oss fra å bruke bredspektrede antibiotika når disse er indisert. I visse tilfeller kan superinfeksjoner måtte aksepteres. Dette gjelder f. eks. hos pasienter i intensivavdelinger som behandles med nyere betalaktamantibiotika.
English summary
Antibiotic-induced superinfections
The term superinfection is used when microbiological and clinical findings indicate a secondary infection in addition to the already existing one. Most frequently they are induced by antibacterial antibiotics which cause changes in the microbial ecology. The inhibitory effect that organisms of the commensal flora in the mouth/throat or other orifices and in the colon exert on many pathogens is thereby abolished. Typical examples of superinfections are candidosis, pseudomembranous colitis and enteritis. The article further reviews clinical, microbiological and therapeutic aspects of superinfections in the oral mucosa and periodontium.
Olsen I, Helovuo H, Løkken P. Antibiotikainduserte superinfeksjoner. Nor Tannlegeforen Tid. 2002;112:46–49. doi:10.56373/2002-01-11
Referanser
1. Day RB. Superinfections in oral surgery. Acta Stomatol Belg 1976; 73: 287 – 9.
2. Weinstein L, Brown RB. Colonization, suprainfection and superinfection: major microbiologic and clinical problems. Mt Sinai J Med 1977; 44: 100 – 12.
3. Edlund C, Hedberg M, Nord CE. Antimicrobial treatment of periodontal diseases disturbs the human ecology: a review. J Chemother 1996; 8: 331 – 41.
4. Nord CE. Studies on the ecological impact of antibiotics. Eur J Clin Microbiol Infect Dis 1990; 9: 517 – 8.
5. Løkken P, Tolo K, Olsen I. Periodontale superinfeksjoner etter bruk av antibiotika. Nor Tannlegeforen Tid 1994; 104: 628 – 30.
6. Olsen I, Tolo K, Løkken P. Mikrober – en del av vårt liv. Periodontal økologi og infeksjon. Nor Tannlegeforen Tid 1994; 104: 580 – 3.
7. Scully C, Cawson RA. Medical problems in dentistry. 4th ed. Somerset: Wright; 1998. p. 408 – 37.
8. Helovuo H. Periodontal superinfections [dissertation]. Turku: University of Turku, Finland; 1986.
9. Helovuo H, Forssell K, Hakkarainen K. Oral mucosal soft tissue necrosis caused by superinfection. Report of three cases. Oral Surg Oral Med Oral Pathol 1991; 71: 543 – 8.
10. Helovuo H, Paunio K. Effects of penicillin and erythromycin on the clinical parameters of the periodontium. J Periodontol 1989; 60: 467 – 72.
11. Helovuo H, Hakkarainen K, Paunio K. Changes in the prevalence of subgingival enteric rods, staphylococci and yeasts after treatment with penicillin and erythromycin. Oral Microbiol Immunol 1993; 8: 75 – 9.
12. Rams TE, Babalola OO, Slots J. Subgingival occurrence of enteric rods, yeasts and staphylococci after systemic doxycycline therapy. Oral Microbiol Immunol 1990; 5: 166 – 8.
13. Rams TE, Feik D, Young V, Hammond BF, Slots J. Enterococci in human periodontitis. Oral Microbiol Immunol 1992; 7: 249 – 52.
14. Jones RN. Gram-positive superinfections following beta-lactam chemotherapy: the significance of the enterococcus. Infection 1985; 13 (Suppl 1): S81 – 8.
15. Odds FC. Candida infections: an overview. Crit Rev Microbiol 1987; 15: 1 – 5.
16. Bystedt H, Josefsson K, Nord CE. Ecological effects of penicillin prophylaxis in orthognatic surgery. Int J Oral Maxillofac Surg 1987; 16: 559 – 65.
17. Stone HH, Haney BB, Kolb LD, Geheber CE, Hooper CA. Prophylactic and preventive antibiotic therapy: timing, duration and economics. Ann Surg 1979; 189: 691 – 9.
18. Tong DC, Rothwell BR. Antibiotic prophylaxis in dentistry: a review and practice recommendations. J Am Dent Assoc 2000; 131: 366 – 74.
19. Thomas JG, Metheny RJ, Karakiozis JM, Wetzel JM, Crout RJ. Long-term sub-antimicrobial doxycycline (Periostat) as adjunctive management in adult periodontitis: effects of subgingival bacterial population dynamics. Adv Dent Res 1998; 12: 32 – 9.
Antibiotika; Infeksjon; Legemidler; Oral Medisin
Adresse: Ingar Olsen, Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo, Postboks 1052 Blindern, NO-0316 Oslo, Norge. E-post: ingaro@odont.uio.no
Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Olsen I, Helovuo H, Løkken P. Antibiotikainduserte superinfeksjoner. Nor Tannlegeforen Tid. 2002;112:46–49. doi:10.56373/2002-01-11