Desmoplastisk fibrom – en sjelden, men aggressiv benign svulst i kjeven
Hovedbudskap
Desmoplastisk fibrom er en benign, men aggressiv beinvevstumor.
Den kan forekomme i kjevene, spesielt i underkjeven.
Behandlingen består av reseksjon eller kyrettasje.
Desmoplastisk fibrom er en godartet tumor i beinvev som imidlertid ikke er innkapslet, og som vokser lokalt infiltrerende med destruksjon av omgivende normalt beinvev. Den kan vokse gjennom kortikalt beinvev og ut i omliggende bløtvev. Pasienten rapporterer oftest om en langsomtvoksende hevelse. Tumor forekommer relativt sjelden, men hele 22 % av alle tilfeller oppstår i mandibula, som også er hyppigste lokalisasjon i kjevene. Vanlige røntgenbilder, panoramarøntgen (ortopantomografi, OPG), cone beam computertomografi (CBCT) og magnetic resonance imaging (MRI) er viktig for undersøkelse, diagnose og behandling. Tumor består av et fibrøst bindevev og fibroblaster med noe oppsvulmede kjerner. Den er som regel relativt cellerik, og cellene er ofte organisert i et fiskestimlignende mønster. Behandlingen består av reseksjon eller mer konservativ behandling som enukleasjon eller kyrettasje.
Denne kasuistikken beskriver det kliniske, radiologiske og histopatologiske bildet av et desmoplastisk fibrom hos en 38-årig kvinne. Selv om desmoplastisk fibrom er en sjelden tumor i kjevene, er den en viktig differensialdiagnose å vurdere ved diagnostikk av fibroossøse lidelser og sarkomer.
Pasientkasus
Klinikk
Pasienten, en 38 år gammel kvinne, var vesentlig frisk, men plaget av migrene og brukte Sumatriptan Blue ved behov. Hun ble henvist til oralkirurg for utredning av en betydelig radiologisk oppklaring i høyre mandibula. De siste to månedene hadde hun hatt smerter i hele høyre underkjeve. Smertene strålte opp mot det høyre øret, og hun hadde en prikkende følelse i høyre underleppe. Ved undersøkelse ble det funnet en lett palpasjonsøm ekspansjon vestibulært og lingualt for ramus mandibula med normal overliggende slimhinne. Det kunne ikke palperes forstørrede submandibulære eller cervikale lymfekjertler.
Radiologi
På OPG fra henvisende tannlege så man i store deler av ramus mandibula en oval radiolusens ispedd opake partier (figur 1). I forandringens periferi var det en diffus sklerotisk sone. Bildene ble supplert med et nytt OPG og CBCT.
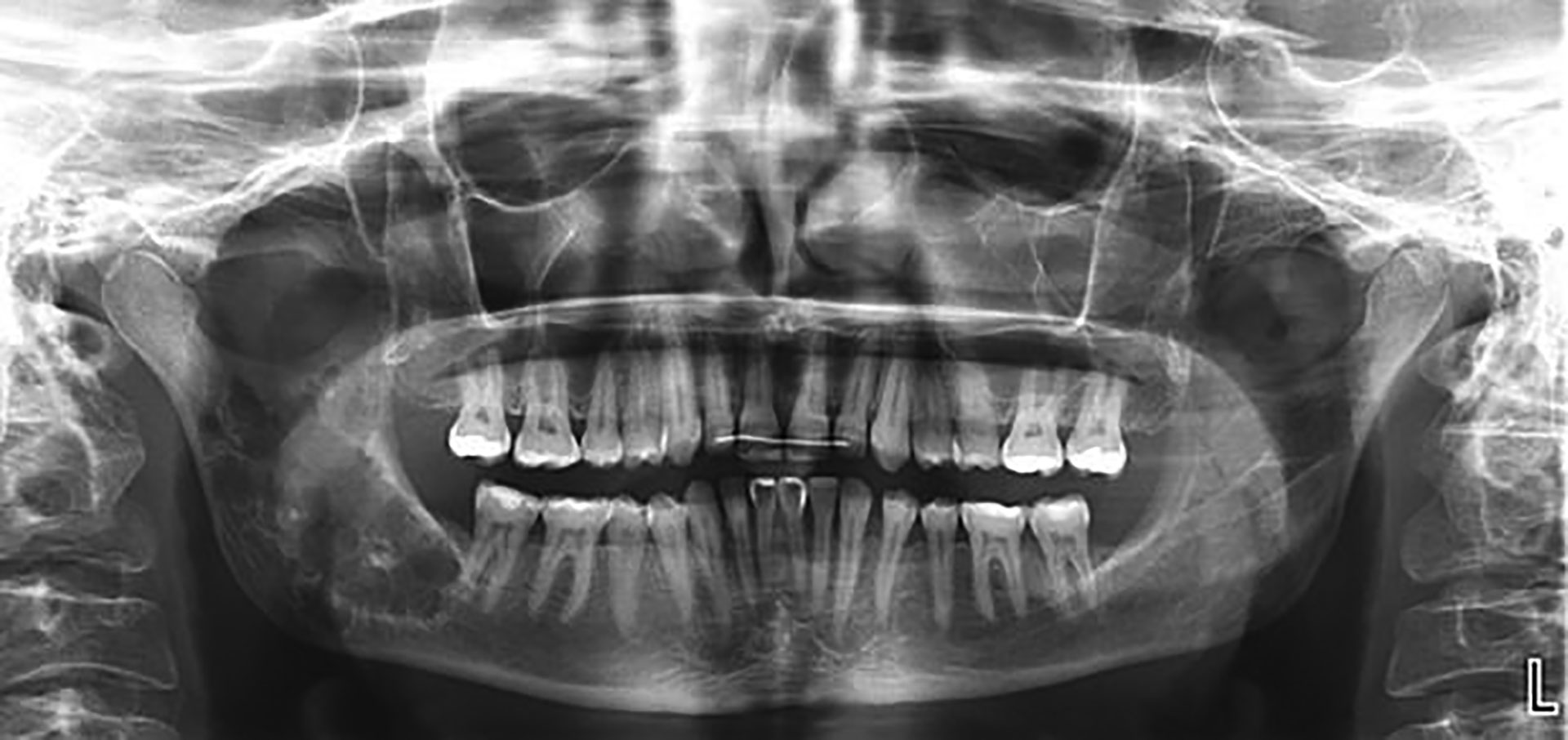
Figur 1 OPG viser multicystisk oppklaring utfyllende det meste av høyre ramus mandibula frem til tann 47.
På CBCT, som ble beskrevet av radiolog, var det en stor uregelmessig, kamskjellformet radiolucent prosess med stedvis noe radiopakt innhold som fylte ut posteriore del av corpus og ramus mandibularis oppad til incisura mandibularis. Prosessen hadde moderat ekspansjon, uttynning og stedvis perforasjon av ytre cortex (figur 2). Omkringliggende beinvev var sklerotisk og reaktivt. Det var ingen tenner i relasjon til prosessen. Canalis mandibularis løp gjennom prosessen, stedvis uten påvisbar kortikal avgrensning. Funnene kunne være forenlig med en infisert cystisk prosess eller benign tumor, men annen tilstand kunne ikke utelukkes.
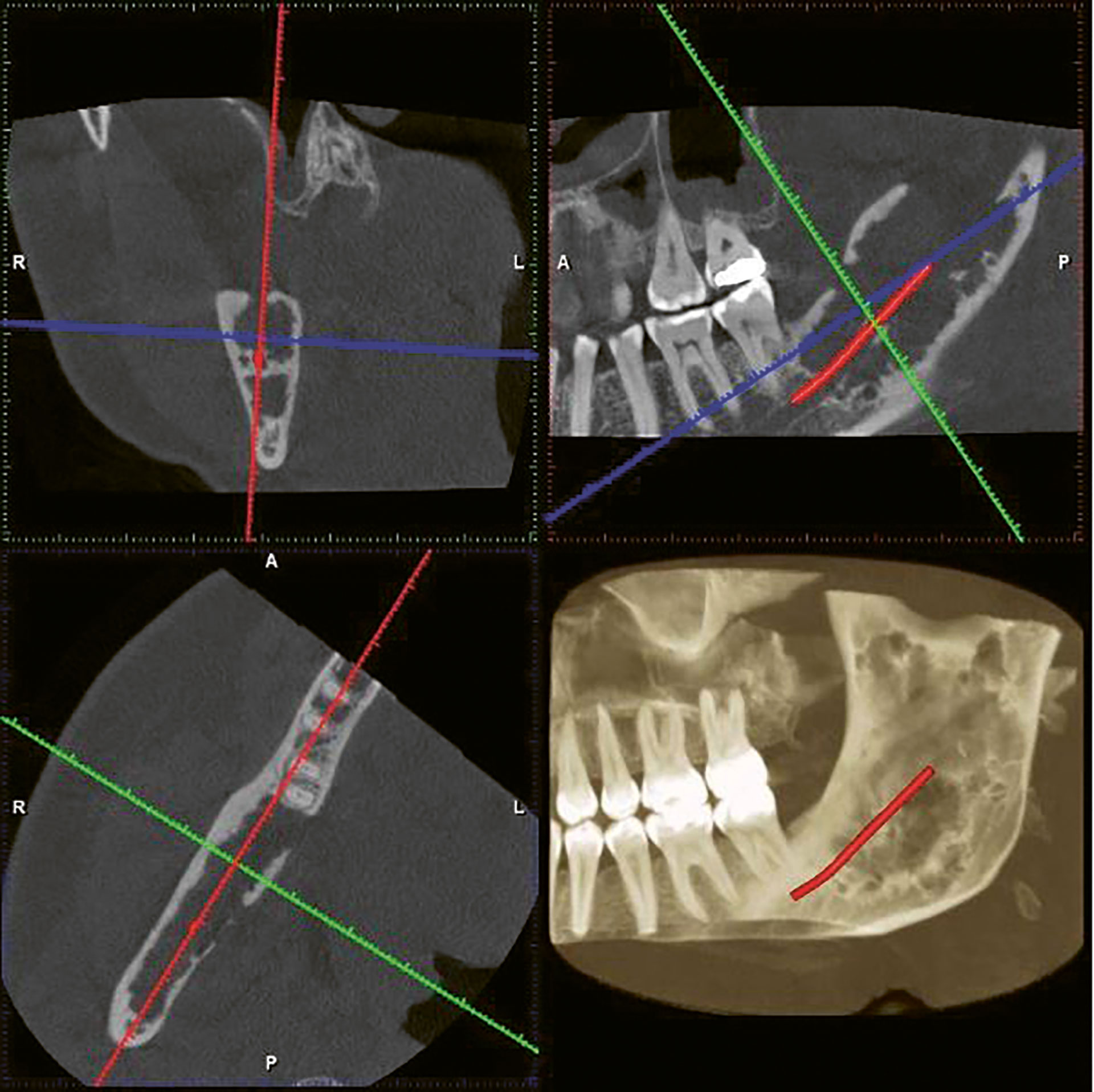
Figur 2 CBCT 2D snapshot i flere plan av prosessen i høyre underkjeve: nede til venstre – aksialsnitt, oppe til venstre – koronalt snitt, oppe til høyre – sagittalt snitt (CBCT og CT viser alltid til denne siden, selv om det er høyre side) og nede til høyre 3D-rekonstruksjon (sett fra lingual/medial side)
Behandling
Det var indikasjon for insisjonsbiopsi. Etter avløsning av mucoperiostallapp kom man inn på et solid tumorvev. Det ble tatt biopsi med et trepanbor. Vevsprøven ble sendt som hasteprøve (CITO) til Avdeling for patologi ved Oslo universitetssykehus, Rikshospitalet.
Histologi
Mikroskopisk fant man i rutinefarget snitt (HE-snitt) et ikke-innkapslet fibrøst bindevev som var relativt cellerikt (figur 3). Fibroblastene var spolformet og dannet et stråmatte- eller fiskestimlignende mønster. De var regelmessige, uten pleomorfi, og det ble ikke sett økt antall mitoser (figur 4). Videre fant man et noe mer finfibret bindevev som inneholdt mange små blodkar. Det var kun et ubetydelig antall kroniske betennelsesceller i vevet. I vevets periferi var det litt nydannet beinvev omgitt av osteoblaster. Beinvevet ble antatt å være metaplastisk/reaktivt.
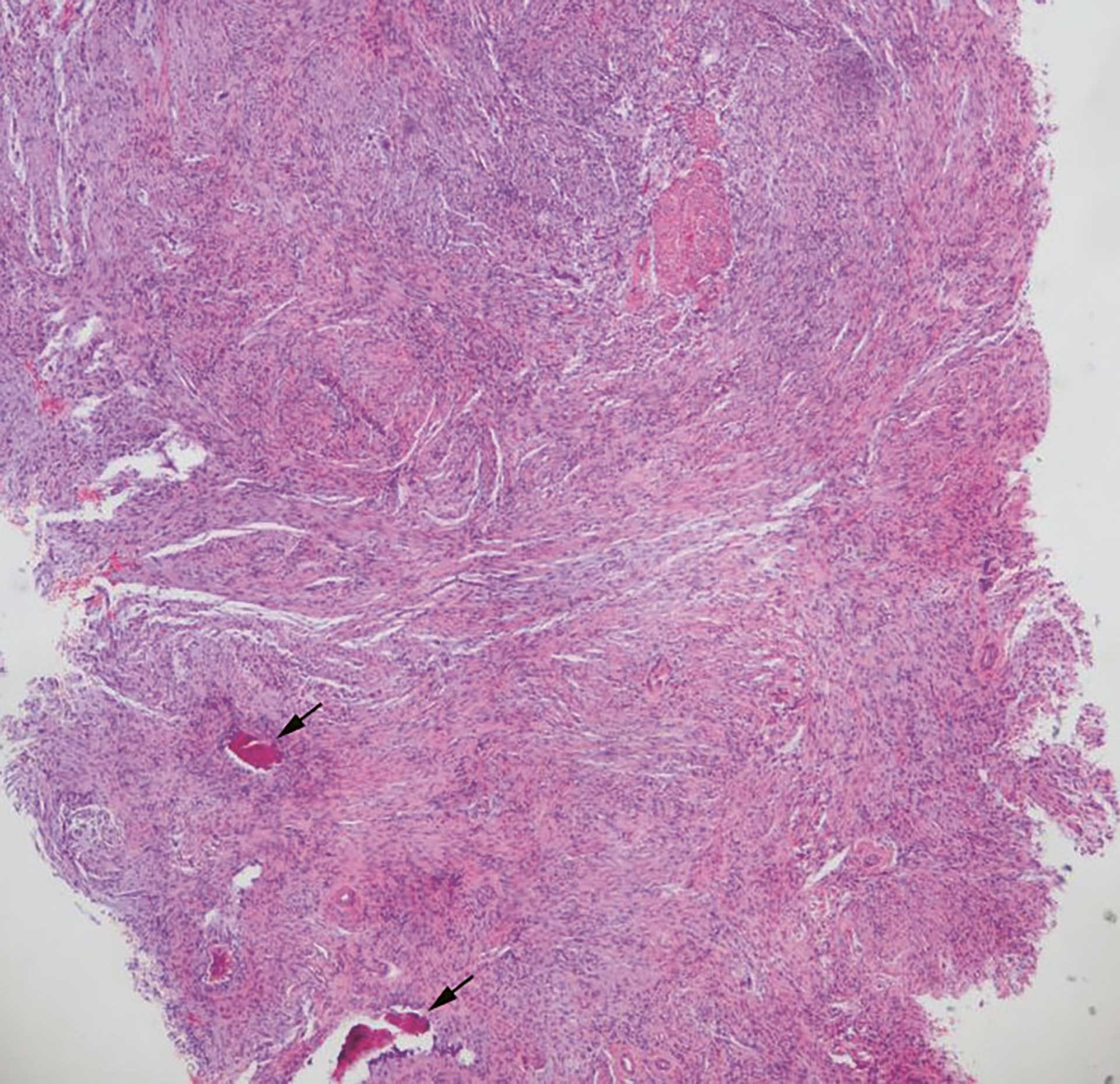
Figur 3 HE 2x objektiv. Fibrøs tumor uten kapsel. Vi ser litt beinvev perifert (pil).
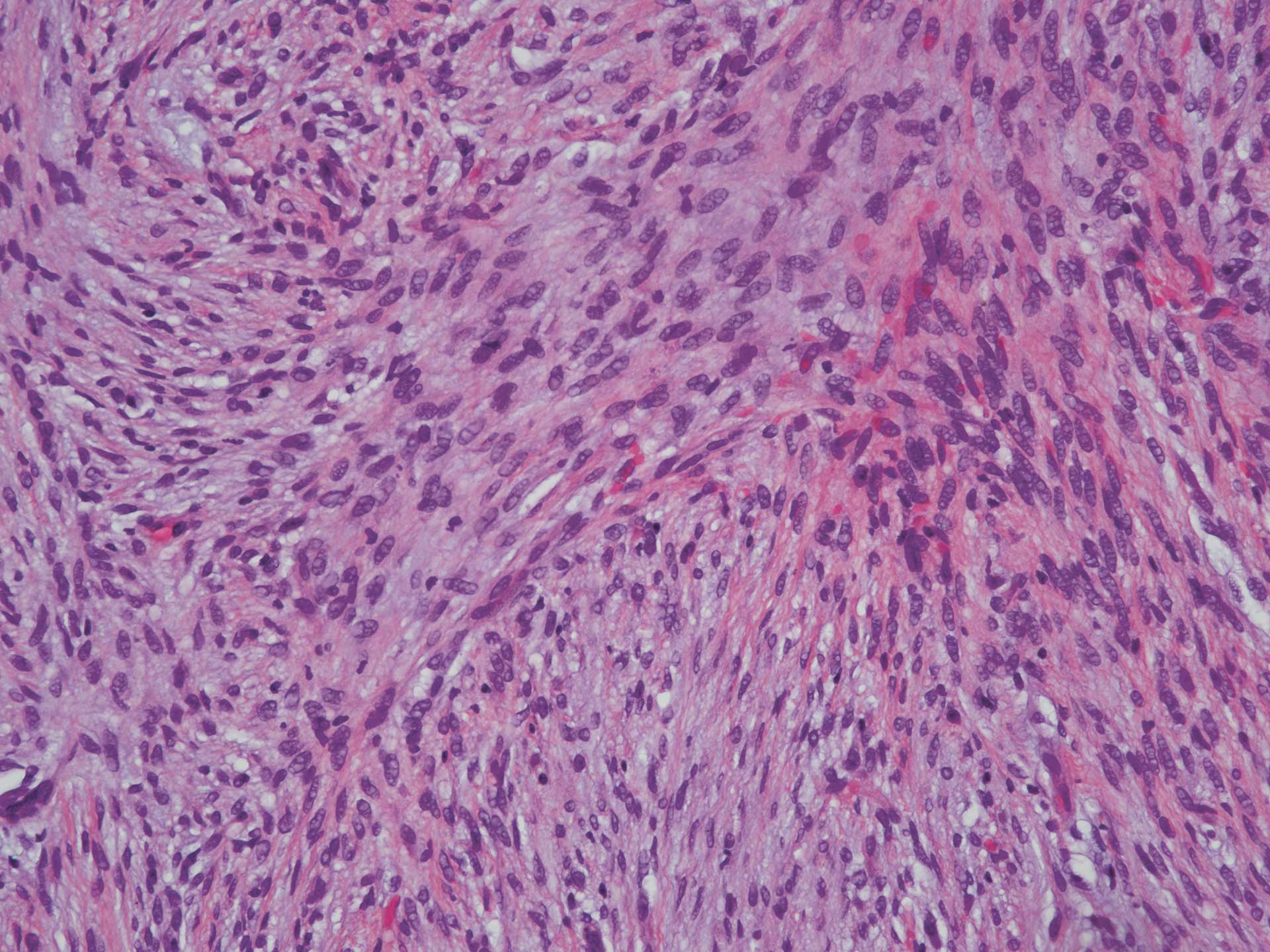
Figur 4 HE 20x objektiv. Spolformede fibroblaster arrangert i et stråmatteformet mønster med orientering i ulike retninger. Vi ser ingen påfallende pleomorfi eller mitoser og heller ingen påfallende forekomst av betennelsesceller.
Det ble utført en rekke immunfarger. Proliferasjonsmarkøren Ki-67 ble vurdert til < 5 %, noe som indikerer en benign tumor (figur 5). Både S-100 (markør for nerveceller og melanocytter) og endotelcellemarkøren CD-34 var negative, og det var dermed lite sannsynlig at tumor hadde oppstått fra disse celletypene. Tumorvevet var positivt for alpha smooth muscle actin (SMA) (figur 6) og muskelcellemarkøren aktin. Beta-catenin (markør for ulike maligne svulster og bindevevssvulster) farget positivt i tumorcellenes cytoplasma, men ikke i deres kjerner (figur 7). ALK (anaplastisk lymfomkinase) var negativ. En slik kombinasjon av markører, sammenholdt med det histologiske bildet på HE-snitt, kunne passe med et desmoplastisk fibrom.
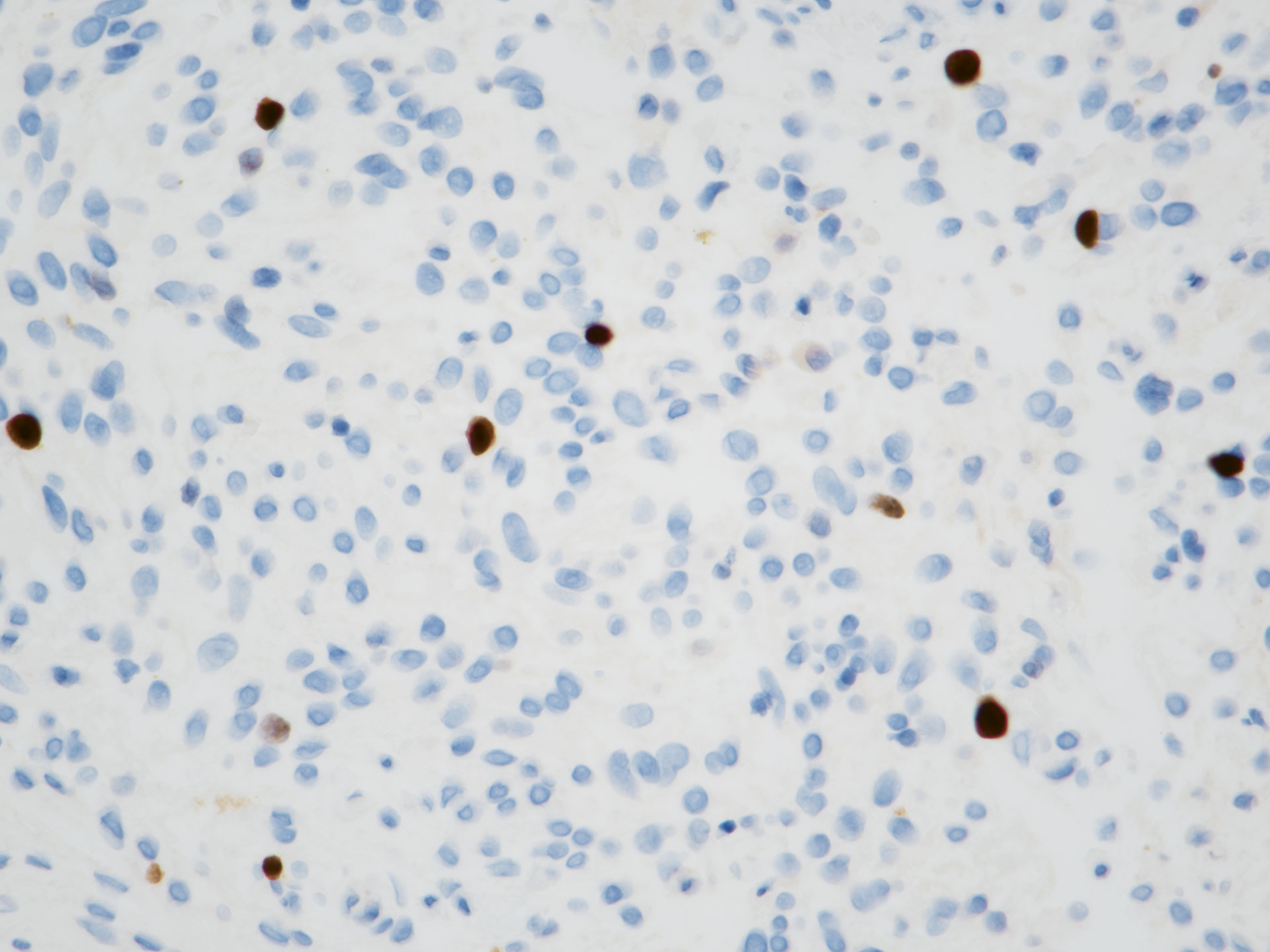
Figur 5 Ki-67-farging, 40 x objektiv. Færre enn 1 av 20 celler farger positivt (< 5 %).

Figur 6 SMA-farging, 40 x objektiv. Positiv farging av fibre og cytoplasma i tumorcellene, men ikke av cellekjernene.
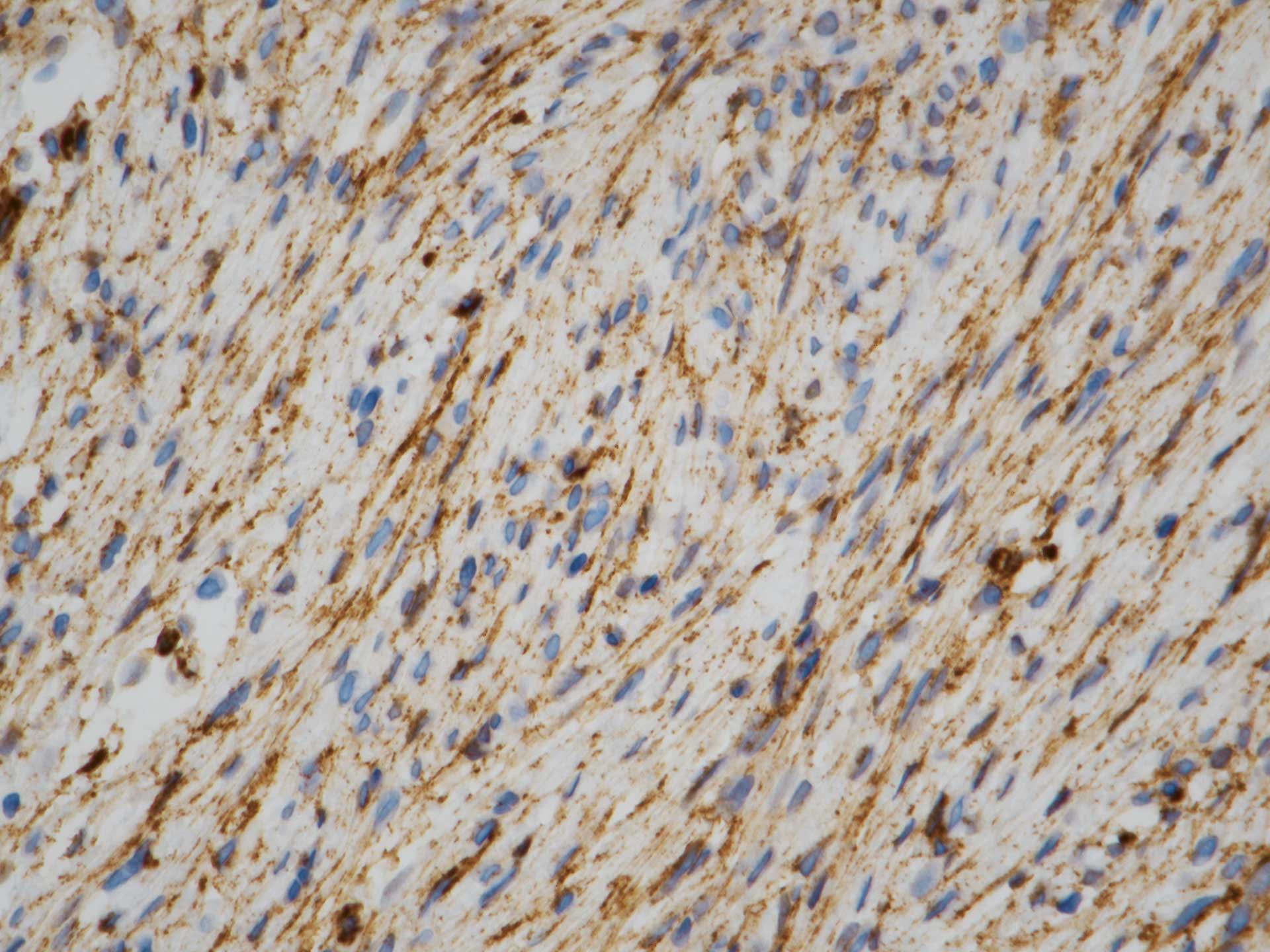
Figur 7 Beta-catenin-farging, 40 x objektiv. Positiv farging av cellenes cytoplasma slik det er vanlig ved desmoplastisk fibrom. Enkelte kjerner synes også å være positive, men det er uvisst hva disse representerer.
På grunn av tumors aggressive utseende på røntgen ble prøven videresendt til Radiumhospitalets sarkomgruppe for å utelukke malignitet, i første rekke en variant av høyt differensiert fibrosarkom. Patologene ved Radiumhospitalet støttet diagnosen desmoplastisk fibrom, og biopsien ble diagnostisert som spolcellet benignt tumorvev, best forenlig med desmoplastisk fibrom.
Oppfølging
Pasienten ble henvist til en tann- og kjevepoliklinikk ved Oslo universitetssykehus, Rikshospitalet, for videre utredning og behandling. Det ble i første omgang utført en computertomografiundersøkelse (CT) (figur 8) og en magnetresonansundersøkelse (MR) (figur 9) som viste at tumor var uten kortikalbegrensning i enkelte områder og hadde kontakt med bløtvev som mylohyoid- og pterygoidmuskulatur på ramus mandibula. Det var ikke noe som tydet på at tumor infiltrerte dette bløtvevet.
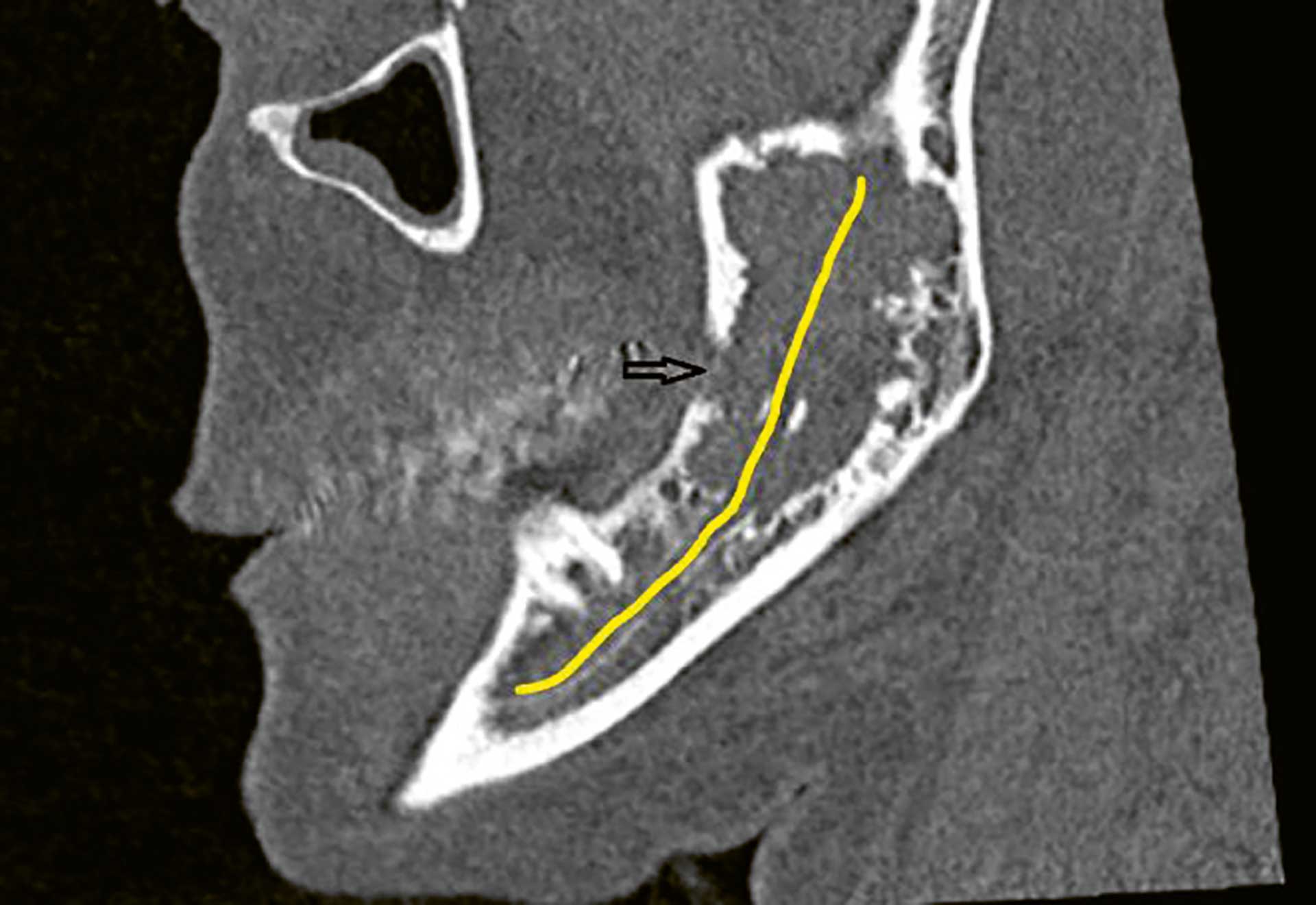
Figur 8 CT av ansiktsskjelettet viser breddeforøkt ramus og angulus, med manglende trabekulært bein i marghulen, og kortikal defekt (svart pil). Den gule linjen markerer nervekanalen/nervus alveolaris inferior.
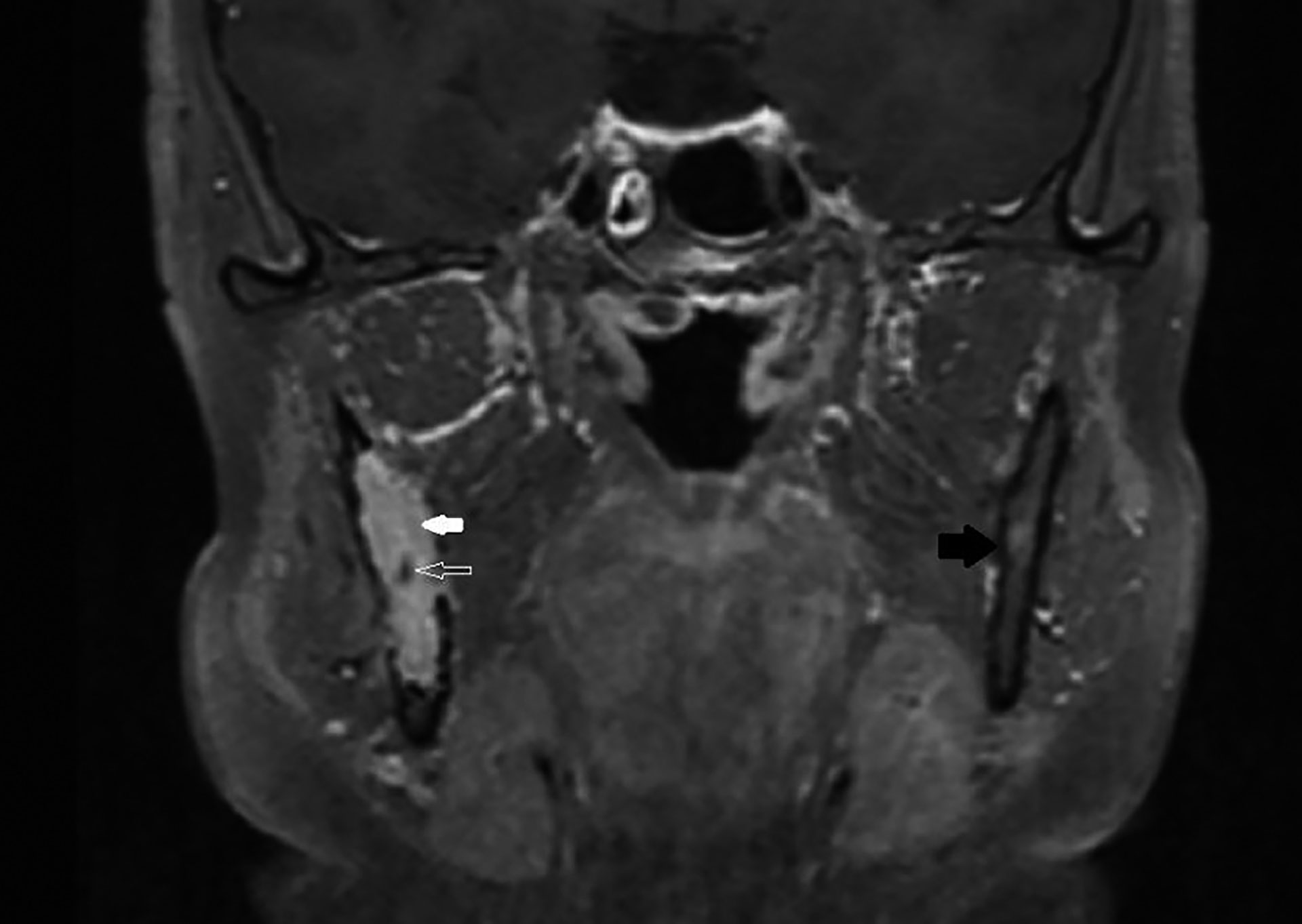
Figur 9 MR med intravenøs kontrast og fettsuppresjon. Hvit, tykk pil på solid, kontrastladende vev i marghulen som omslutter nervus alveolaris inferior (hul og hvit pil). Svart pil mot friskt kortikalt og medullært bein på kontralateral side.
CT viste en uregelmessig lytisk forandring som målte 25 x 10 x 40 mm. Flere områder viste kortikalt gjennombrudd, både medialt og lateralt. Ramus var breddeforøket, som ved ekspansiv vekst. Nervus alveolaris inferior forløp gjennom forandringen og var blottlagt uten synlig beindekning i store deler av forløpet.
MR (figur 9) viste en lobulær, solid forandring som var uendret i omfang, sammenlignet med CT-undersøkelsen tre måneder tidligere. Nervus alveolaris inferior forløp upåvirket gjennom svulsten. På steder der det manglet beindekning, var det ikke tegn til reaksjon i inntilliggende bløtvev. Radiologisk var funnene forenlig med en solid, ekspansiv, men ikke-infiltrerende svulst.
Kasuset ble diskutert på et multidisiplinært møte på Rikshospitalet, og forskjellige behandlingsstrategier ble diskutert. Disse inkluderte observasjon av tumor, enukleasjon eller reseksjon av tumor med samtidig rekonstruksjon. Det siste ville være mutilerende for pasienten, og enukleasjon ville derfor være å foretrekke dersom dette var mulig. Pasienten hadde i samme periode økende symptomer i form av smerter og hypoestesi i nervus alveolaris inferior. Det ble derfor planlagt å forsøke konservativ behandling med enukleasjon om mulig. Opprinnelig ble inngrepet utsatt i to år som følge av svangerskap og fødsel. Tumor hadde ikke endret utbredelse under denne perioden.
Primo april 2025 ble det utført enukleasjon av tumor i narkose. For tilgang ble det utført en osteotomi langs laterale del av ramus mandibula. Man fant ingen kapsel rundt tumor, som løsnet relativt lett fra beinet. Klinisk var det noe vanskelig å avgrense tumor fra nervus alveolaris inferior, men man fjernet det man klinisk oppfattet som tumorvev rundt nerven, som i utstrekning syntes å være intakt. Det ble jevnet over skarpe beinkanter. Kaviteten ble inspisert klinisk uten å gjenfinne sikkert tumorvev. Såret ble dekket over med Tachosil matriks, og det var god hemostase. Deretter ble det suturert med kontinuerlig og avbrutte suturer av type Novosyn 4/0.
Pasienten sto under inngrepet på 2 g Keflin intravenøst og fortsatte med Amoxicillin 500 mg x 3, syv dager postoperativt. Ved kontroll 14 dager postoperativt ble det avdekket infeksjon, og det ble utført drenasje av en mindre abscess intraoralt, lateralt om kjevekammen. I tillegg ble pasienten satt på Apocillin 1 g x 4 og Flagyl 400 mg x 3 i ti dager. Ved kontroll medio mai 2025 var infeksjonen i remisjon, og det var tilnærmet normal sensibilitet i innervasjonsområdet til nervus alveolaris inferior. Det ble planlagt videre tett oppfølging av pasienten med ny CT høsten 2025.
Diskusjon
Desmoplastisk fibrom ble navnsatt av Jaffe i 1958, men tilstanden hadde på dette tidspunktet vært kjent i mer enn 100 år [1]. Det første tilfellet i kjevene ble publisert i 1965 av Griffith og Irby [2]. Årsaken til utviklingen av desmoplastisk fibrom er ukjent, men man antar at en multifaktoriell årsakssammenheng er sannsynlig. Traumer, endokrine faktorer og genetiske forandringer er foreslått [3][4].
Desmoplastisk fibrom er en sjelden svulst og utgjør kun 0,3 % av alle benigne beinvevssvulster, men kjevene er predileksjonssted [5]. Hele 22 % av alle tilfeller av desmoplastiske fibromer forekommer i mandibula [1][3], hvor 80 % av kjevetilfellene oppstår i mandibula. Langt de fleste oppstår i posteriore del av mandibula som i vårt kasus [6][7][8]. Selv om tumor er hyppigst hos unge pasienter (70 % oppstår før 30-årsalderen), kan den ramme alle aldersgrupper. Svulsten har en lett predileksjon for kvinner [9]. Tumor presenteres vanligvis som en smertefri hevelse, men smerter kan forekomme, slik som i vårt kasus [9][10]. Den lokalt destruktive og ekspanderende veksten av tumor i vårt kasus hadde stedvis perforert cortex, noe som også er beskrevet av andre [1][4][5].
Radiologi
Desmoplastisk fibrom sees på røntgen som en mer eller mindre velavgrenset unilokulær eller multilokulær radiolucens [4][8]. I vårt tilfelle var de multicystiske oppklaringene velavgrensede. Iblant kan man finne forskyvning av tenner, med eller uten rotresorpsjon [3][11]. Det desmoplastiske fibromet i vårt kasus lå like bak tann 47, men det var ikke tegn til forskyvning eller resorpsjon av den. CT synes å være den vanligste metoden for radiologisk undersøkelse og diagnose og er spesielt nyttig for å finne tumors begrensninger [4]. MR er spesielt nyttig for å planlegge kirurgi og skiller også godt desmoplastisk fibrom fra normal beinmarg [1]. Ultrasonografi/ultralyd har vært forsøkt [12], men funnet mindre nyttig.
Histologi
Tumorvevet består av et modent fibrøst bindevev med noe plumpe, spolformede fibroblaster, men uten at de er pleomorfe. Tumorcellene viser svært få mitoser [8][10]. De kollagene fibrene er tettpakket og ligger i bunter. Tumor er ikke kapselkledd, den vokser lokalt infiltrerende og kan ha fokale områder med myksoid degenerasjon [3][8]. Ofte finner man reaktiv beindanning i periferien, men ikke som en del av tumor [8][10].
Immunhistokjemi
Det finnes ingen spesifikk immunhistokjemisk markør for desmoplastisk fibrom, men en kombinasjon av ulike markører kan være til hjelp for å skille denne tumoren fra andre spolcellede svulster og forandringer. Ved et desmoplastisk fibrom er tumorcellene av type myofibroblaster og farger som regel positivt for SMA og vimentin, men oftest negativt for S100 [4]. Videre er det beskrevet at tumorcellenes cytoplasma som regel farger positivt for beta-catenin, mens kjernene farger negativt [8][9]. Andel positive celler for proliferasjonsmarkøren Ki-67 er som regel < 5 % [1][4][7][8].
Differensialdiagnoser
De viktigste differensialdiagnosene inkluderer fibrøs dysplasi, desmoid fibromatose, lavgradig fibrosarkom og lavgradig sentralt osteosarkom [9]. Dersom biopsien ikke tas dypt nok, kan man finne perifer beindanning, og desmoplastisk fibrom kan da lett feildiagnostiseres som en fibro-ossøs lidelse [3]. Fibrøs dysplasi kan i tvilstilfeller utelukkes ved sekvensering eller fluorescens in situ hybridiseringsanalyser (FISH), hvor det ved fibrøs dysplasi vil påvises GNAS (Guanine Nucleotide binding protein, Alpha Stimulating Active pepide 1)-mutasjon [9]. Desmoid fibromatose er en bløtvevstumor som kan vokse infiltrerende inn i bein, i motsetning til desmoplastisk fibrom som oppstår i beinvev og kan infiltrere bløtvevet. Disse kan ikke skilles histologisk i HE-snitt, og dersom det er tvil om tumor har oppstått i bløtvev eller bein, kan immunhistokjemisk farging med beta-catenin være til hjelp. Ved desmoid fibromatose er denne positiv i kjerner, mens den er negativ i desmoplastisk fibrom [13]. I slike tilfeller kan immunhistokjemisk farging med beta-catenin være til hjelp, da tumorcellene ved desmoid fibromatose har positiv kjernefarging for denne markøren i motsetning til i et desmoplastisk fibrom. Inflammatorisk myofibroblastisk tumor er en mulig differensialdiagnose som vi også har vurdert [13]. Selv om den er sjelden, er det beskrevet flere tilfeller i kjevene [14]. Negativ ALK-farging bidro til å utelukke denne svulsten.
Av de maligne differensialdiagnosene var høyt differensiert osteosarkom mindre aktuell da det ikke ble sett osteoid. I tvilstilfeller kan fravær av MDM2 (Mouse Double Minute 2)-genamplifikasjon utelukke osteosarkom [15]. En variant av lavgradig fibrosarkom var mer aktuelt i dette kasuset. Det er fra tidligere år rapportert tilfeller hvor denne er feildiagnostisert som desmoplastisk fibrom, og omvendt [16][17]. Selv om Ki-67 vanligvis er høyere i sarkomer enn i vårt kasus, er det rapportert tilfeller av høyt differensierte myofibroblastiske sarkomer hvor Ki-67 har vært under 5 % [18]. Dette var også en årsak til at vi i vårt tilfelle konfererte med Radiumhospitalets sarkomgruppe.
Behandling og prognose
Valg av behandling for benigne svulster med et aggressivt vekstmønster i kjevene vil bestemmes etter en avveining av residivfare opp mot morbiditet [19]. For desmoplastisk fibrom er det rapportert 30–70 % risiko for residiv etter konservativ kirurgi (kyrrettasje eller enukleasjon), mens det ved kirurgisk reseksjon er rapportert en betydelig lavere residivtendens, helt ned mot 5 % [3][4][10]. Reseksjon er imidlertid forbundet med betydelig morbiditet, som nedsatt tyggefunksjon og parestesi av underleppen [18]. Behandlingen må derfor avveies etter risiko for residiv opp mot risiko for estetiske og funksjonelle sekveler. I dette tilfellet ble det valgt konservativ kirurgi og nøye oppfølging av pasienten med tanke på residiv. Grunnet residivtendensen er det anbefalt å følge opp pasienten med kontroller i minst tre år etter behandling [1][4].
Til orientering: Pasienten har gitt skriftlig tillatelse til publisering.
Sammendrag
Desmoplastic fibroma – a rare but aggressive benign tumor of the jaw
Desmoplastic fibroma is a non-encapsulated benign bone tumour characterized by an infiltrative growth pattern that leads to the destruction of surrounding normal bone tissue. It has the potential to perforate cortical bone and extend into adjacent soft tissue. Although relatively rare, 22% of the cases occur in the mandible, making it the most common site within the jaws. Standard radiological examinations, including orthopantomograms, cone beam computer tomography and magnetic resonance imaging are essential for evaluation, diagnosis, and treatment planning. The tumor is composed of fibrous connective tissue and fibroblasts, which often exhibit somewhat swollen nuclei. The tumor tissue is usually quite cellular, with cells organized in a storiform pattern. Treatment for desmoplastic fibroma primarily involves the resection of the affected bone. While curettage has also been attempted, it has resulted in a high rate of recurrence.
This case report describes the clinical, radiological, and histopathological features of a desmoplastic fibroma in a 38-year-old woman. Although desmoplastic fibroma is an uncommon tumor of the jaws, it is an important differential diagnosis to consider when evaluating fibro-osseous disorders and sarcomas.
Keywords: benign tumor of bone tissue, non-encapsulated, multicystic, myofibroblasts
Referanser
Schneider M, Zimmermann AC, Depprich RA, Kübler NR, Engers R, Naujoks CD, et al. Desmoplastic fibroma of the mandible – review of the literature and presentation of a rare case. Head Face Med. 2009;5:25–29. doi: 10.1186/1746-160X-5-25
Griffith JG, Irby WB. Desmoplastic fibroma. Report of a rare tumor in the oral stuctures. Oral Surg Oral Med Oral Pathol. 1965;20:269–75.doi: 10.1016/0030-4220(65)90201-x
Said-Al-Naief N, Fernandes R, Louis P, Bell W, Siegal GP. Desmoplastic fibroma of the jaw: A case report and a review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006;101:82–94.
Woods TR, Cohen DM, Islam MN, Rawal Y, Bhattacharyya I. Desmoplastic fibroma of the mandible; A series of three cases and review of the literature. Head Neck Pathol. 2015;9:196–204.
Buhl J, Pedersen U, Steiniche T, Fink-Jensen V. Desmoplastisk fibrom i mandibelen. Ugeskrift for læger 2005; Nov. 4.
Khatib B., Pogrel MA. Desmoplastic fibroma of the mandible in young children – a case series. Internat J Oral Maxcillo Surg. 2017;46(2):173–80. https://doi.org/10.1016/j.ijom.2016.09.018
Karimi A, Derakhshan S, Khiavi MM, Mosavat F, Mirjalili. Desmoplastic fibroma of the jaws: A case series and review of the literature. Iran J Pathol. 2020;15(2):134–143
Kahraman D, Karakoyunlu B, Karagece U, Ertas U, Gunhan O. Desmoplastic fibroma of the jaw bone: A series of twenty-two cases. J Bone Oncol. 2021;26;100333–9.
WHO. WHO Classification of Tumours Editorial Board. Head and neck tumours. 5. utg. Lyon (France): International Agency for Research on Cancer; 2024.
Neville BW, Damm DD, Allen CM, Chi AC. Oral and maxillofacial pathology. 4. utg. Elsevier; 2016. s.613–614.
Loureiro FJA, Nogueira WR, Dutra MJ, Stelter GO, Schuch LF, Silveira FM, et al. Desmoplastic fibroma of the gnathic bones – A systematic review. Oral Dis. 2025;31(1):32–38. https://doi.org/10.1111/odi.15153
Gersak MM, Lenghel LM, Baciut G. Moldovan I, Mitea H, Botar-Jid C, et al. Ultrasonography of desmoplastic fibroma of the mandible: a case report. Med Ultrason. 2015;17:407–10.
Baranov E, Hornick JL. Fibroblastic and myofibroblastic neoplasms of the head and neck. Head Neck Pathol. 2020;14:43–58.
Monteiro L, Alhassani M, Resende T, Albuquerque R. Inflammatory myofibroblastisk tumor of the jaw: A rare presentation. J. Stomatol Oral Maxillofac Surg. 2020;121:90–4.
Bertin H, Gomez-Brouchet A, Rédini F. Osteosarcoma of the jaws: an overview of the pathophysiological mechanisms. Crit Rev Oncol Hematol. 2020 ;156: 103126,
Slootweg PJ, Müller H. Central fibroma of the jaw, odontogenic or desmoplastic. A report of five cases with reference to differential diagnosis. Oral Surg Oral Med Oral Path. 1983;56:61–70
Hietanen J, Lukinmaa P-L, Calonius PEB, Kassila O. Desmoplastic fibroma involving the mandible. Br J Oral Maxillofac Surg. 1986;24:442–7.
Giraldo-Roldan D, Gonçalves De Paiva JP, Roza ALOC, Louredo BVR, Santos-Leite EG, et al. Oral and maxillofacial low-grade myofibroblastic sarcoma: a systematic review. Head Neck Pathol. 2025;19:63. https://doi.org/10.1007/s12105-025-01783-1
Cakarer S, Isler SC, Keskin B, Uzun A, Berberoglu HK, Keskin C. Treatment for the large aggressive benign lesions of the jaws. J Maxillofac Oral Surg. 2018;17;372–8. https://doi.org/10.1007/s12663-017-1060-5
Nøkkelord: benign svulst i beinvev, ikke innkapslet, multicystisk, myofibroblaster
Akseptert for publisering 02.02.2026. Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Solhaug MB, Andersen E, Berstad JER, Hustvedt GW, Falkenberg-Jensen B, Søland T, Solheim T. Desmoplastisk fibrom – en sjelden, men aggressiv benign svulst i kjeven. Nor Tannlegeforen Tid. 2026;. doi:10.56373/06034c3152ff