Genetiske diagnoser som medfører utviklingsforstyrrelser i emalje og dentin
Hovedbudskap
Ved diagnostisering av dentale utviklingsforstyrrelser i tennenes hårdvev skal man være observant med tanke på eventuelle andre tegn som kan indikere at den dentale diagnosen er en del av et større klinisk bilde. Skyldes tannfunnene generell sykdom eller syndrom?
I de tilfellene man i tillegg til en dental utviklingsforstyrrelse ser andre tegn på at den dentale diagnosen er en del av et større klinisk bilde er samhandling med annet helsepersonell av stor viktighet.
En grundig anamnese, klinisk undersøkelse samt dokumentasjon med kliniske fotografier og eventuelle røntgenbilder før restaureringer gjennomføres, er viktig for så tidlig diagnostisering som mulig.
Etter å ha stillet en diagnose for den dentale utviklingsforstyrrelsen, bør man utarbeide en kort- og langsiktig behandlingsplan, vurdere videre henvising og om epikrise skal sendes fastlege
Tennene har blitt omtalt som kroppens ferdsskrivere. Dette fordi både genetiske forandringer, autoimmune tilstander, tanntraumer, ulike somatiske tilstander, ytre faktorer og miljø kan påvirke amelogenesen og dentinogenesen. Dentale utviklingsforstyrrelser i tennenes hårdvev bør derfor utredes bredt, da de kan ha sammenheng med både sykdom og syndromer.
Et syndrom kan ha en genetisk eller ikke genetisk årsakssammenheng og kan medføre dentale utviklingsforstyrrelser i tennenes hårdvev – emalje og dentin. Det er viktig at tannhelsepersonell identifiserer mulige sammenhenger mellom dentale utviklingsforstyrrelser og eventuelle ekstraorale symptomer og funn. Å se «hele individet» er viktig for å kunne oppdage eventuelle sammenhenger. Det kan være bidragende ved syndromdiagnostikk.
Eksempler er Autoimmunt polyendokrint syndrom type 1 og cøliaki (APS1, Tricho-dento-ossøst syndrom og Hypofosfatesi.)
Tannhelsepersonell må kjenne betydningen av systematikk ved diagnostisering, tverrfaglig samhandling og vurderinger man må gjøre før man eventuelt rekvirerer genetiske analyser.
Mange pasienter vil ha behov for individuelt tilpasset oppfølging og behandling hele livet, og tidlig diagnostikk er viktig for å kunne yte den beste behandlingen i et kort- og langsiktig perspektiv for det enkelte individ.
Et syndrom er et medisinsk uttrykk for at en samling av symptomer og tegn som ofte opptrer sammen, og kan inndeles på ulike måter. Et hovedskille går mellom genetiske og ikke-genetiske syndromer [1]. En rekke genetiske syndromer medfører utviklingsforstyrrelser i emalje og dentin [2]. Med denne artikkelen ønsker vi å få frem betydningen av at tannhelsepersonell besitter kunnskap om genetisk betingende tannutviklingsforstyrrelser og identifiserer mulige sammenhenger med ekstraorale symptomer og funn. Videre ønsker vi å belyse at tannhelsepersonell er en del av helsetjenestene, og kan bidra ved syndromdiagnostikk og være en del av en helhetlig behandlingstjeneste for pasienter som har dentale utviklingsforstyrrelser som del av et genetisk syndrom. Mange pasienter vil ha behov for individuelt tilpasset oppfølging og behandling hele livet. Vi vil illustrere dette med noen eksempler på aktuelle syndromer. Syndromene som beskrives er ment å være eksempler, og illustrere betydningen av at tannhelsepersonell gjennomfører grundig anamnese og registrerer eventuelle ekstraorale funn hos pasienter med dentale utviklingsforstyrrelser.
Amelogenesis imperfecta (AI) og Dentinogenesis imperfecta (DI) er de vanligste genetisk betingede tannutviklingsforstyrrelsene, og de er grundig beskrevet i Tandlægebladet tidligere [3]. I de fleste tilfeller av AI og DI dreier det seg om isolerte tilstander som kun rammer de dentale vev, men i noen tilfeller er de del av en medfødt genetisk sykdom eller syndrom [4]. Noen medfødte diagnoser som fører til utviklingsforstyrrelse i emalje eller dentin er også godt beskrevet i Tandlægebladet tidligere, mer spesifikt diagnosene epdermolysis bullosa, fokal dermal hypoplasi, ostegogenesis imperfecta og x-bundet hypofosfatemisk rakitt [5]. Disse omtales derfor ikke i denne artikkelen selv om de alle betegnes som syndromer med betydelig påvirkning på emaljens utvikling.
AI har blitt kategorisert både etter klinisk bilde, arvemønster, molekylære endringer og biokjemisk utfall ved kjent mutasjon [6]. I og med at man i dag sjelden utfører genetiske undersøkelser for diagnostisering av tannutviklingsforstyrrelser, benyttes ofte en inndeling som beskrevet av Witkop og Raos med klassifisering der diagnosen deles inn i tre hovedgrupper; hypomaturasjonstype, hypokalsifikasjonstype og hypoplasitype, med underkategorier [7].
DI inndeles ofte i DI-I, DI-II og DI-III, mens Dentindysplasier (DD) inndeles i to hovedgrupper; DD-1 Og DD-2 [3][5][8][9].
De fleste utviklingsforstyrrelser i emalje og dentin påvirker både utseende (fenotype) og kvaliteten på tennene. Noen arvelige tannutviklingsforstyrrelser kan likevel best ses radiologisk, eksempelvis mildere dentindysplasier [3].
Ved AI vil det ved noen typer ha moderat alvorlighetsgrad i det primære tannsett, men for DI er det oftest motsatt og primære tenner slites ofte helt ned til gingivalnivå. Begge tilstander har mange ulike fenotyper, fra helt milde til alvorlige tilstander og ved DI, også pulpaaffeksjoner. Tilstandene kan opptre alene eller som en del av et syndrom eller sykdom [9].
Ved klinisk diagnostisering er det viktig å være klar over differensialdiagnoser til de mer kjente genetiske utviklingsforstyrrelsene, som eksempelvis dental fluorose (figur 1E,F), molar hypomineralisering (MIH) (figur 1E,G) [10], og utviklingsforstyrrelser oppstått etter lokale påvirkninger i en gitt periode under tannutviklingen som ved febersykdommer, strålebehandling og tanntraumer. Man må ikke glemme at karies også er en differensialdiagnose (figur 1D). En grundig klinisk undersøkelse med røntgen (dersom klinisk berettigelse) samt en generell- og spesiell anamnese er av stor betydning for utredningen av diagnose (figur 2). Svangerskap, fødsel, drikkevannskilde (fluoridkonsentrasjon), spedbarn- og småbarnstid må kartlegges og tidligere tanntraumer og sykdommer identifiseres og journalføres. I tillegg bør man kartlegge om det er familiemedlemmer med lignende funn da det gir informasjon om mulig arvegang.
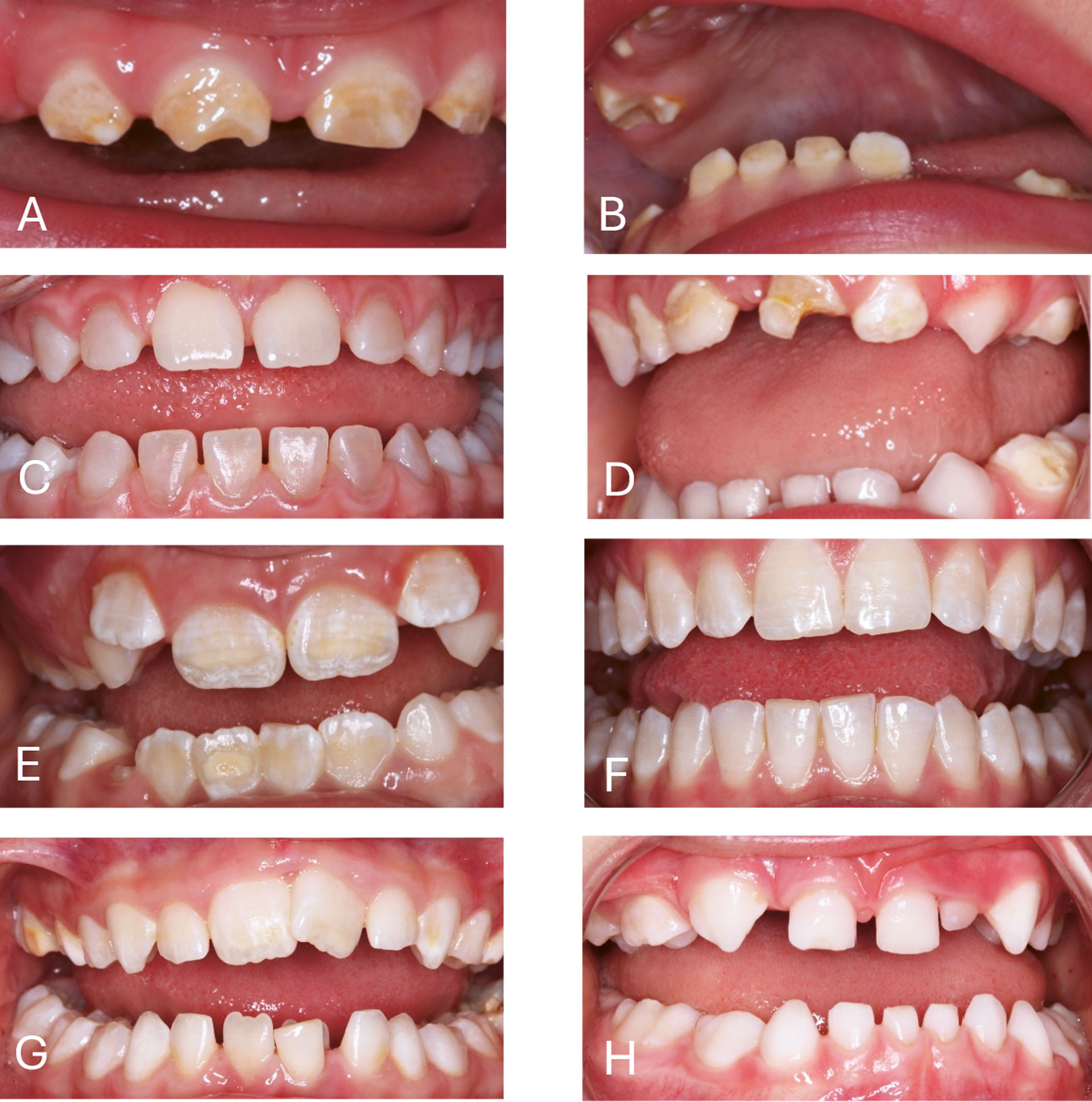
Figur 1. Eksempler på Amelogenesis imperfecta (AI), Dentinogenesis imperfecta (DI) og ulike differensialdiagnoser.
A og B, AI hos 1,5 år gammelt barn (autosomal dominant arv). C – DI D – Småbarnskaries (ECC). E – Kombinasjon av dentalfluorose (DF) og Molar inscisiv hypomineralisering (MIH). F – DF. G – MIH. H – Udiagnostisert atypisk tannmorfologi og manglende 52.
(Foto: Avd. for pedodonti, Institutt for klinisk odontologi, Det odontologiske fakultet, Universitetet i Oslo.)
Røntgenbilder må granskes med tanke på retinerte eller displasserte tenner, agenesier, anatomi på røtter og pulpa, forholdet dentin-emalje og eventuelle andre patologiske funn. Funn bør dokumenteres i tanndiagram, med påtegning og gradering av utviklingsforstyrrelser i emaljen samt kliniske fotos. Digitale foto som lagres i journal kan ha stor betydning, da det ofte er lettere å diagnostisere utviklingsforstyrrelser når man kan forstørre bildene på skjerm. I tillegg er fotos viktige for dokumentasjon senere i livet, når eventuell behandling har maskert de opprinnelige defektene (figur 2).

Figur 2. Prosess for utredning av utviklingsforstyrrelser i emalje/dentin.
(Illustrasjon av Matias Sandvik, Nasjonalt senter for sjeldne diagnoser, enhet munnhelse, Lovisenberg Diakonale Sykehus, Oslo.)
Tennene har blitt omtalt som kroppens ferdsskrivere. Dette grunnet hvordan både genetiske forandringer, autoimmune tilstander og miljø kan påvirke amelogenesen og dentinogenesen [11]. Ved å se på lokalisering av defekter og sammenholde dette med kunnskap om stadier av tannutvikling ved gitte aldre vil man kunne si noe om bakenforliggende årsak. Ved de genetisk betingede AI og DI vil man ikke se slike kronologiske sammenhenger, da begge tannsett vil være affisert i ulik grad og det ikke vil være en klinisk kronologisk sammenheng.
En oversikt og forsøk på klassifisering av genetisk betingende tannutviklingsforstyrrelser ble publisert i 2019 [2]. Dentale anomalier ble delt i åtte undergrupper, hvorav utviklingsforstyrrelser i emalje og dentin utgjorde to. Da artikkelen ble publisert var det beskrevet 21 gener som fører til isolerte emaljeutviklingsforstyrrelser og hele 84 gener som ga opphav til genetiske syndromer der emaljeutviklingsforstyrrelser er et av flere tegn. Disse diagnosene ble igjen inndelt i hudtilstander, øyetilstander, bensykdommer, endokrine og gynekologiske tilstander, nyretilstander, intellektuelle utviklingsforstyrrelser, øre-nese-hals tilstander, immunologiske tilstander og hjertefeil. Ikke like mange gener er beskrevet å gi opphav til dentinutviklingsforstyrrelser, fem gener er beskrevet å gi isolerte utviklingsforstyrrelser i dentin og 30 gener er knyttet til ulike bensykdommer.
I tilfeller hvor man diagnostiserer utviklingsforstyrrelser i tennenes hårdvev samt også observerer andre medisinske funn, er det av stor betydning for individet at det opprettes en henvisning og dialog med andre helsetjenester for samhandling, noe som vi illustrerer i diagnosene som beskrives videre i artikkelen.
Eksempler på genetiske diagnoser som kan gi utviklingsforstyrrelser i emalje og dentin
Flere genetiske diagnoser kan påvirke utviklingen av dentale hårdvev. Vi har i denne artikkelen valgt å beskrive noen diagnoser som har litt ulike mekanismer med hensyn til hvordan de påvirker amelo- og dentinognesen.
Autoimmunt polyendokrint syndrom type 1 (APS1) og cøliaki
Diagnosen APS1, er i artikkelen til La Dure-Molla [2] klassifisert som en diagnose i gruppen emaljeutviklingsforstyrrelser og endokrine og gynekologiske sykdommer, selv om diagnosen nok også kunne vært klassifisert under immunologiske tilstander, da dette er sammensatt. Diagnosen illustrerer dermed på en god måte hvordan en genforandring kan påvirke ulike deler av kroppen. Diagnosen skyldes en mutasjon i genet AIRE som fører til at AIRE-proteinet mister sin funksjon, en såkalt funksjonstapsmutasjon [12]. I en normal situasjon virker AIRE som en transkripsjonsregulator og er viktig for at thymus etablerer det man kaller «sentral toleranse», det vil si at immunforsvaret kan skille (og dermed tolerere) det som kommer fra egen kropp fra det som er fremmed [13][14]. APS1 medfører dermed ulike autoimmune tilstander i kroppen, eksempelvis hypoparathyreodisme, primær binyrebarksvikt, kronisk mukokutan candidiasis og betydelig økt risiko for utvikling av oral cancer [15]. Emaljedannelsen er i varierende grad forstyrret hos 70–90 % av individer med diagnosen (figur 3) [16].
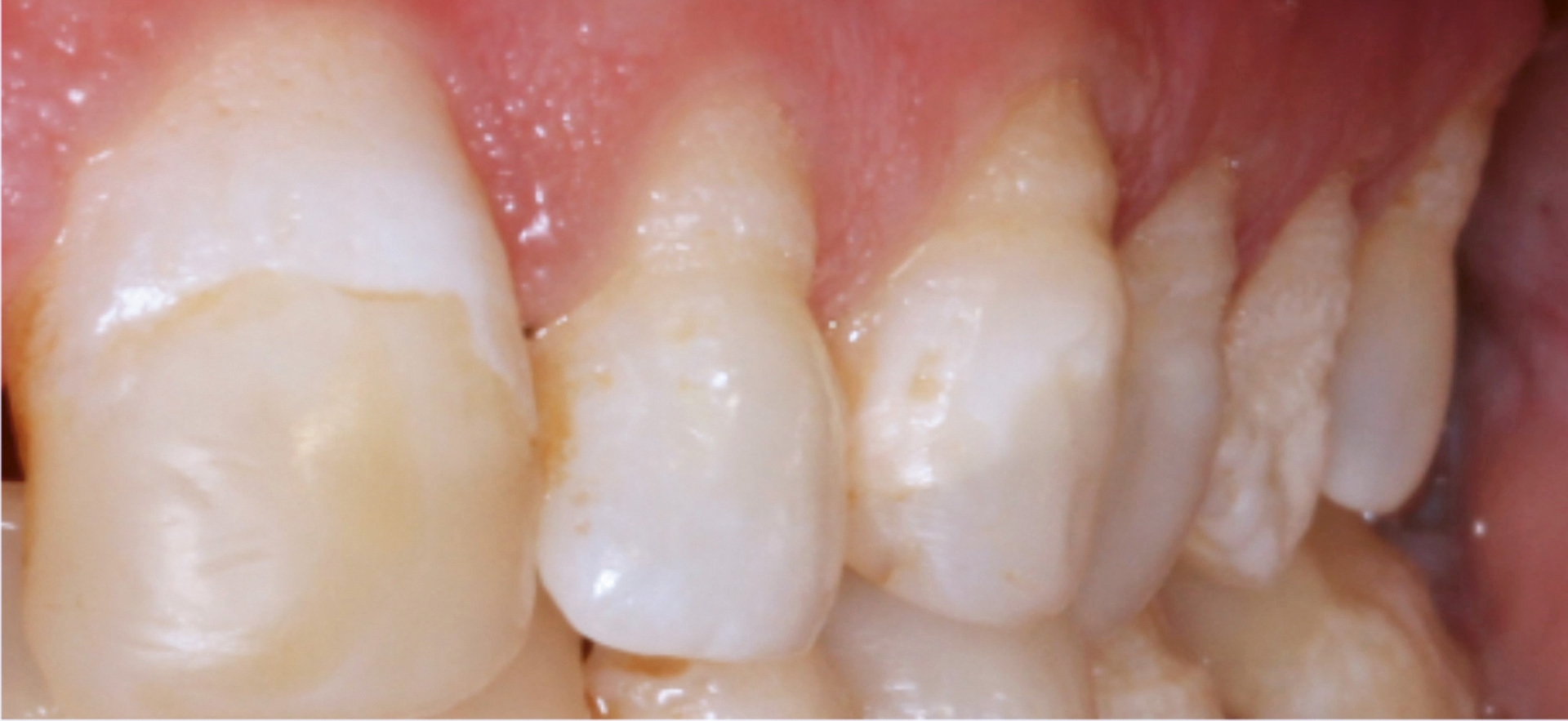
Figur 3. Fotografi av klassiske emaljeforstyrrelser ved APS1 der særlig den incisale/okklusale delene av tannkronene er affiserte.
Foto: Nasjonalt senter for sjeldne diagnoser, enhet munnhelse, Lovisenberg Diakonale Sykehus, Oslo.
De molekylære mekanismene som fører til emaljeutviklingsforstyrrelser ved denne diagnosen er ikke fullstendig kartlagt, men det har vært to hovedteorier; enten at AIRE har en direkte funksjon i emaljeutviklingen, eller at det er involvert i induksjon av toleranse for ameloblast-spesifikke antigener i thymus.
Interessant nok har 20–50 % av barn med cøliaki, som også er en auotoimmun diagnose, lignende emaljeutviklingsforstyrrelser som observeres ved APS1. Ved cøliaki er det også beskrevet to mulige årsaker til emaljeutviklingsforstyrrelsene; malabsorpsjon av næringsstoffer og mineraler eller immunmedierte mekanismer [16]. I en nylig publisert artikkel i Nature [17][11] mener forfatterne å demonstrere at den immunmedierte teorien er den mest sannsynlige, ved at de viser at de fleste pasienter med APS1 og Cøliaki utvikler autoantistoffer, i hovedsak av typen IgA, mot ulike ameloblast-spesifikke proteiner som er med å danne emaljematrix. De kaller denne tidligere uidentifiserte IgA-avhengige autoimmune tilstanden for autoimmun AI.
Tricho-dento-ossøst syndrom
En annen form for syndromal amelogenesis imperfecta, klassifisert som en bensykdom av La Dure-Molla et al [2], er Tricho-dento-ossøst sydrom (TDO). I tillegg til emaljeutviklingsforstyrrelser, (figur 4A) karakteriseres TDO av utviklingsforstyrrelser i hår, ben og negler [18]. Prevalensen av denne diagnosen er ukjent. Dette kan skyldes at den er veldig sjelden, men det er også mulig den hos enkelte er udiagnostisert, da det, som nevnt over, ikke er vanlig å gjøre genetiske undersøkelser av pasienter med tannutviklingsforstyrrelser. Det er stor variasjon i klinisk bilde både mellom- og innen familier med diagnosen, og emaljeutviklingsforstyrrelsene kan være de mest uttalte funnene. I tillegg er det beskrevet at det ofte forekommer taurodonti (figur 4B)
Syndromet skyldes mutasjon i genet DLX3 (distal-less homeobox gene) på kromosom 17.
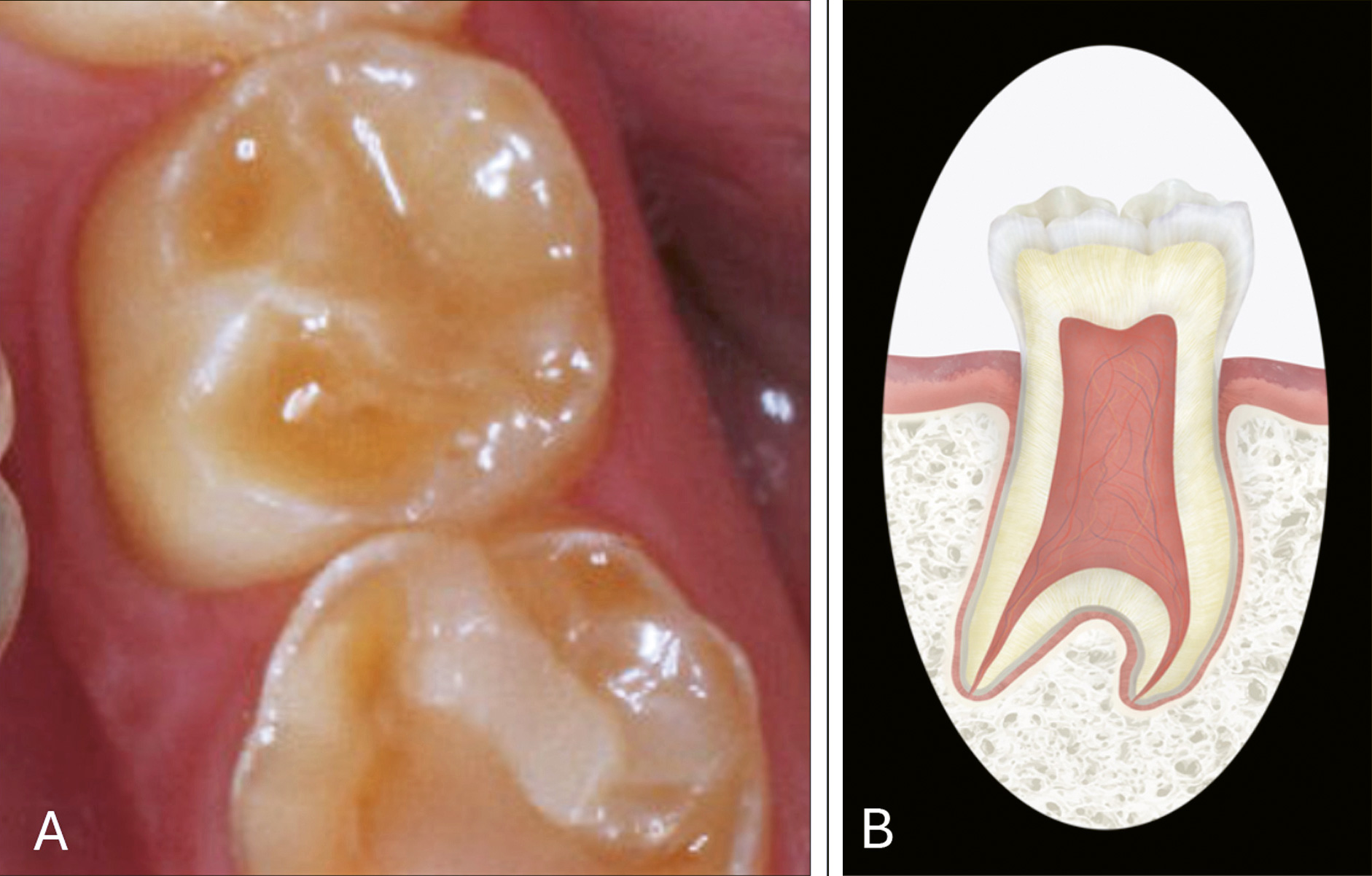
Figur 4. Typiske tannfunn hos en pasient med Tricho-dento-ossøst syndrom. A: Emaljen er svært tynn. B: Taurodonti betyr at kronepulpa i molarer er forlenget og furkasjonen displassert mot det apikale. Figuren viser dette i en ekstrem form.
Illustrasjon av Malin Bernas-Theisen, Nasjonalt senter for sjeldne diagnoser, enhet munnhelse. Lovisenberg Diakonale Sykehus, Oslo. Foto: Nasjonalt senter for sjeldne diagnoser, enhet munnhelse. Lovisenberg Diakonale Sykehus, Oslo.
Hypofosfatesi
Hypofosfatasi er et eksempel på en diagnose som rammer dentinutviklingen i tillegg til flere andre organsystemer. I klassifikasjonen til La Dure-Molla, klassifiseres den som en dentin- og bendiagnose [2]. Diagnosen knyttes til patologiske endringer (mutasjoner) i genet ALPL som koder for proteinet alkalisk fosfatase. Den direkte følgen av endringer i ALPL genet er at det blir mindre fosfat i blodet. Fosfat er viktig i mange organsystemer, som ben, tenner, lever og nyrer. Det finnes ulike former for hypofosfatasi, med ulik alvorlighetsgrad, hvor den mildeste formen, odontohypofosfatasi, rammer kun tennene, mens svært alvorlige former som oftest oppdages allerede i fosterlivet og kan være letale. Når flere organer er involvert kan det forekomme symptomer og tegn som, skjelettsmerter, bøyde rørknokler, hyppige benfrakturer, redusert muskeltonus og kortvoksthet. I tillegg observeres det dentinutviklingsforstyrrelser og i mange tilfeller prematurt tap av melketenner (figur 5A) og da uten nevneverdig resorpsjon av roten slik man ser når melketenner felles normalt (figur 5B). Det er naturlig at dentindannelsen påvirkes ved tilstander som påvirker mineraliseringsprosesser i ben, og redusert mineralisering av sement er antagelig også en medvirkende faktor til det tidlige tanntapet [18].
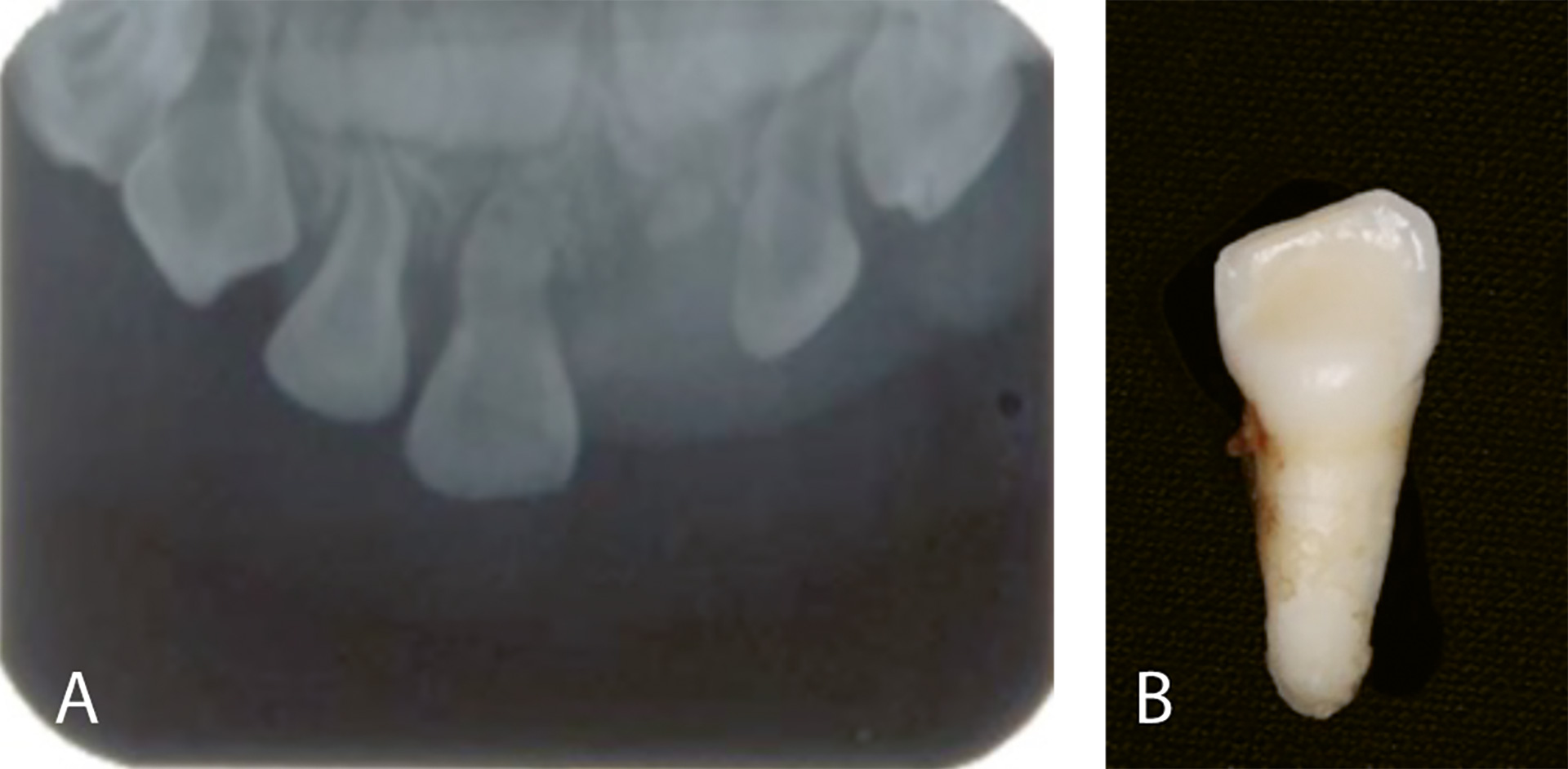
Figur 5. Klassiske tannfunn som observeres ved hypofosfatasi. A: Røntgenbilde av et barn på 5 år som viser tegn på dentin dysplasia med store pulparom. B: Foto av en tann som er eksfoliert prematurt med full rotlengde, et klassisk funn ved hypofosfatasi.
Ved mistanke om en sammensatt genetisk tilstad/syndrom, hva er viktig for tannhelsepersonell å tenke på?
Tverrfaglig samhandling
Som diagnosebeskrivelsene over viser er ulike munnhulefunn, som emalje og dentinutviklingsforstyrrelser, ofte av genetisk opphav og kan være del av et større bilde. Tannhelsepersonell må derfor alltid vurdere slike utviklingsforstyrrelser i sammenheng med anamnestiske opplysninger og ekstraorale tegn og symptomer som kan være diagnoserelaterte (figur 2). Det kan ikke forventes at tannhelsepersonell skal inneha detaljert kunnskap om alle genetiske diagnoser der munnhulefunn er inkludert, men de bør kunne sette funn inn i en større sammenheng, henvise til andre helsetjenester ved behov og delta i videre utredning, samhandling og behandlingsplanlegging i en helhetlig sammenheng.
Kan og bør tannhelsepersonell rekvirere genetiske undersøkelser?
I Norge reguleres bruk av genetiske undersøkelser gjennom Bioteknologilovens kapittel fem [*]. I loven defineres genetiske undersøkelser som alle typer analyser av menneskets arvestoff, både på nukleinsyre- og kromosomnivå, av genprodukter og deres funksjon, eller organundersøkelser, som har til hensikt å gi informasjon om menneskets arveegenskaper. Loven skiller mellom diagnostiske genetiske undersøkelser som utføres for å stille en diagnose hos en person med symptomer og genetiske undersøkelser for å se på risiko for fremtidig sykdom. Sistnevnte undersøkelser har særskilt regulering og kan bare uføres av godkjente virksomheter.
I prinsippet kan tannhelsepersonell rekvirere diagnostiske genetiske undersøkelser, men det har vært noe diskusjon i litteraturen hvorvidt dette er et ansvar tannleger bør ta [19]. I praksis er det få i tannhelsesystemet som gjør dette og fokusgruppeintervjuer av spesialister i pedodonti viste at det vil kreve profesjonell utvikling, «up-to date ressurser» og tydelige retningslinjer for indikasjoner og oppfølging ved eventuelle funn på de genetiske testene.
Konklusjon
Denne artikkelen er tenkt som en opplysning til tannhelsepersonell om deres unike mulighet til å se dentale utviklingsforstyrrelser i en større sammenheng. Munnen, er som vi stadig påpeker, en viktig del av kroppen, og da bør vi utrede det vi ser utenfor det normale, dokumentere, tidlig diagnostisere, samhandle og legge individuelle behandlingsplaner på kort- og lang sikt. Hvordan opplever pasientene å ha en dental utviklingsforstyrrelse?
Systematikk er viktig og vurderinger om eventuelle genetisk undersøkelser hører også til innen odontologien.
Tannhelsetjenesten er en viktig samarbeidende helsetjeneste, og kan bidra ved syndromdiagnostikk og være en del av en helhetlig behandlingstjeneste for pasienter som har dentale utviklingsforstyrrelser som del av et genetisk syndrom.
Referanser
Store medisinske leksikon. Syndrom. (Set 15.09.24). Tilgjængelig fra: URL: https://sml.snl.no/syndrom og https://snl.no/.taxonomy/4220
La Dure Molla, Fournier BP, Manzanares MC, Acevedo AC, Hennekam RC, Friedlander L et al. Elements of morphology: Standard terminology for teeth and classifying genetic dental disorders. Am J Med Genet , 2019;L179:1913-1981
Hermann X, Daugaard-Jensen J, Lempert JS, Nørregaard M-LM, Hermann NV. Emaljedysplasi eller dentinanomali? Ætiologi, diagnostik og behandlingsovervejelser ved medfødte, isolerede tanddannelsesforstyrrelser i emalje og dentin. Tandlægebladet 2023;127:982-91.
Gadhia, K., McDonald, S., Arkutu, N., & Malik, K. Amelogenesis imperfecta: an introduction. Br Dent J, 2012. 212(8), 377-379. https://doi.org/10.1038/sj.bdj.2012.314
Gjørup Hans. Dysplasi af emalje eller dentin ved medfødt, arvelig sygdom. Tandlægebladet 2023;127:992-99.
Aldred, M. J., Savarirayan, R., & Crawford, P. J. Amelogenesis imperfecta: a classification and catalogue for the 21st century. Oral Dis, 2003. 9(1), 19-23. https://doi.org/10.1034/j.1601-0825.2003.00843.x
Rao S. & Witkop C.J.Jr. Inherited defects in tooth structure. Birth Defects Orig Artic Ser, 1971.7(7), 153-184.
Shields ED, Bixler D, el-Kafrawy AM. A proposed classification for heritable human dentine defects with a description of a new entity. Arch Oral Biol.1973:18:543-53.
De Coster, P.J. (2009), Dentin Disorders. Endod Topics, 21: 41-61. https://doi.org/10.1111/j.1601-1546.2012.00272.x
Hubbard MJ, Mangum JE, Perez VA and Williams R. A Breakthrough in Understanding the Pathogenesis of Molar Hypomineralisation: The Mineralisation-Poisoning Model. Front. Physiol. 2021.12:802833. doi: 10.3389/fphys.2021.802833
Gruper Y, Wolff ASB, Glanz L, Spoutil F, Marthinussen MC, Osickova A, et al. Autoimmune amelogenesis imperfecta in patients with APS-1 and coeliac disease. Nature. 2023;624(7992):653-62
Gjersvik P. og Paus B. Tidsskr Nor Legeforen 2021Vol. 141.do10.4045/tidsskr.21.0377
Aschenbrenner K, D’Cruz LM, Vollmann EH, Hinterberger M, Emmerich J, Swee LK et al. Selection of Foxp3+ regulatory T cells specific for self antigen expressed and presented by Aire+ medullary thymic epithelial cells. Nat Immunol. 2007;8:351-8.
Wyss L, Stadinski BD, King KG, Schallenberg S, McCarthy NI. Lee JY et al. Affinity for self antigen selects Treg cells with distinct functional properties. 2016; 17: 1093-101.
Perheentupa J. Autoimmune polyendocrinopathy-candidiasis-ectopdermal dystrophy. J Clin Endocrinol Metab, 2006;91:2843-50
Pavlic A, Waltimo-Siren J. Clinical and microstructural aberrations of enamel of deciduous and permanent teeth in patients with autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy. Arch Oral Biol. 2009;54:658-65.
Gruper Y, Wolff ASB, Glanz L, Spotil F, Marthinussen MC, Osickova A et al. et al. Autoimmune amelogenesis imperfecta in patients with APS-1 and coeliac disease. Nature 2023
Al- Batayne OB. Tricho-dento-osseous syndrome: diagnosis and dental management. Int J Dent. 2012: doi: 10.1155/2012/514692
Lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven) Kapittel 5. Genetiske undersøkelser av fødte m.m. (Set 29.09.2024) Tilgjængelig fra: URL: https://lovdata.no/nav/lov/2003-12-05-100/kap5/%C2%A75-6
Pousette Lundgren G, Dahllöf G. Outcome of restorative treatment in young patients with amelogenesis imperfecta. A cross-section-al, retrospective study. J Dent 2014; 42:1382-9.
English summary
Genetic diagnoses leading to developmental disturbances in enamel and dentine –the important role of dental health professionals
Teeth have been described as the body's flight recorder because they can reflect a range of genetic changes, autoimmune conditions, dental trauma, systemic disorders, and environmental influences. These factors can impact amelogenesis and dentinogenesis, leading to dental developmental disorders in the hard tissue of teeth. Thorough investigation of these disorders is essential, as they may be linked to broader diseases and syndromes.
Disorders that affect dental tissue, such as enamel and dentin, can have either genetic or non-genetic causes. Identifying potential connections between dental developmental disorders and extra-oral symptoms is crucial for dental health professionals, as it may aid in the diagnosis of underlying syndromes. A holistic approach that considers the “whole individual” is key to recognizing these associations.
Highlighted examples include autoimmune polyendocrine syndrome type 1 and coeliac disease (APS1), tricho-dento-osseous syndrome, and hypophosphatasia.
The importance of systematic diagnosis, interdisciplinary collaboration, and the potential role of genetic testing are emphasized.
Many patients will require personalized follow-up and treatment throughout their lives, making early diagnosis essential to ensuring the best possible care both in the short and long term.
Emneord: Amelogenesis imperfecta; dentinogenesis imperfecta; syndrome; disease; genetic testing
Akseptert for publisering 11.11.2024. Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Rønneberg A.Nordgarden H. Genetiske diagnoser som medfører utviklingsforstyrrelser i emalje og dentin. Nor Tannlegeforen Tid. 2025;135:652-8. doi:10.56373/68b05c1cb043c