Sammenheng mellom selvrapportert lungehelse og periodontitt
Hovedbudskap
Periodontittpasienter med økt gingival blødning og mer dentalt plakk rapporterte om flere luftveissymptomer
Periodontittdiagnose hadde ikke betydning for selvrapportert lungehelse
Periodontittpasienter i vedlikeholdsbehandling rapporterte om færre luftveisymptomer sammenlignet med pasienter i aktiv periodontal behandling
Funnene styrker hypotesen om at periodontal behandling kan ha positiv effekt på lungehelse
Formål: Å undersøke assosiasjonen mellom selvrapportert lungehelse og periodontitt hos voksne.
Metode: Studiepopulasjonen var 70 ikke-røykende voksne pasienter som mottok behandling for periodontitt ved Odontologisk Universitetsklinikk, Universitetet i Bergen. Inkluderte pasienter mottok et validert elektronisk spørreskjema for å kartlegge lungehelsen. Informasjon om periodontal status og behandling ble hentet fra journal. Assosiasjoner mellom lungehelse og periodontale parametere ble undersøkt ved hjelp av tosidige T-tester, Kji-kvadrat tester og logistiske regresjonsanalyser.
Resultat: Totalt 65,7 % av pasientene var i periodontal vedlikeholdsfase (trinn 4). Å våkne med tung pust var signifikant assosiert med økt BI (p=0,013) og PI (p=0,010). Sammenlignet med pasienter i trinn 4 rapporterte signifikant flere pasienter i aktiv periodontal behandling (trinn 1-3) å ha våknet med tung pust (p=0,007) eller hatt pipelyder i brystet (p=0,003) det siste året. Pasienter i trinn 4 hadde 5,38 ganger høyere odds for å våkne med tung pust, sammenlignet med pasienter i trinn 1-3.
Konklusjon: Det ble funnet sammenhenger mellom å våkne med tung pust og økt periodontal inflammasjon og infeksjon. I tillegg til dette rapporterte pasienter i aktiv periodontal behandling oftere å våkne med tung pust og å ha pipelyder i brystet. Dette styrker teorien om at orale bakterier har en påvirkning på respiratorisk epitel og at periodontal behandling kan ha en positiv effekt på lungehelsen.
Flere studier har undersøkt om periodontitt kan ha en direkte eller indirekte påvirkning på lungekapasitet [1]. Ved periodontal sykdom skjer det et økologisk skifte og en endring av normalfloraen i munnhulen. Endringer i mikrofilmen gir oppvekst av periodontale patogener som kan påvirke en rekke inflammatoriske prosesser. Det eksisterer flere teorier som har til hensikt å forklare sammenhengen mellom periodontitt og nedsatt lungehelse (figur 1). Både periodontitt og visse lungesykdommer er multifaktorielle sykdommer som er assosiert med systemisk inflammasjon [2] der bakteriell infeksjon er kjent for å være en medvirkende faktor [3]. På grunn av den tette anatomiske forbindelsen mellom munnhulen og luftveiene kan mikroorganismer fra den orale biofilmen aspireres ned i luftveiene, noe som kan fremme inflammasjon [4]. Siden sammensetningen av mikrober i de øvre og nedre luftveiene er tilnærmet like, kan det økologiske skiftet i munnhulen gi mulighet for endret sammensetting av mikroorganismer også i lungene [5]. Tidligere studier viser at større mengde dental biofilm hos innlagte sykehuspasienter var assosiert med sykehuservervet pneumoni [6].
Figur 1
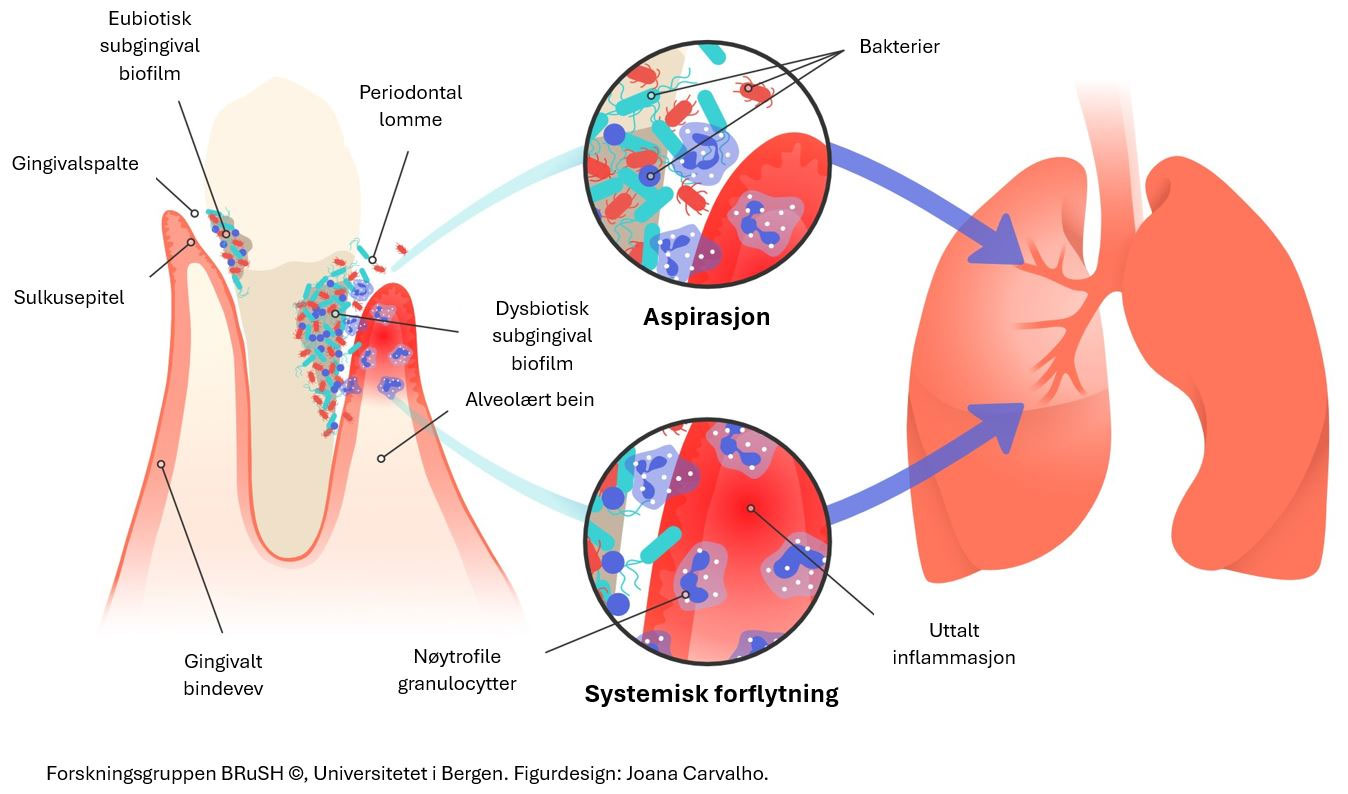
Figur 1. Sammenhengen mellom periodontitt og lungehelse
I tillegg til aspirasjon kan bakterier og inflammasjonsmediatorer spres hematogent. I inflammert periodontalt vev kan bakterier og inflammasjonsmediatorer krysse epitelbarrieren og forflyttes til blodbanen [7]. Vertens immunforsvar kan derfor igangsette en inflammatorisk respons ved interaksjon med bakterier og deres baktericider selv fjernt fra bakteriens opprinnelige tilholdssted.
Periodontitt er assosiert med flere ulike lungesykdommer. En nylig publisert studie viste at individer diagnostisert med periodontitt oftere fikk komplikasjoner av kronisk obstruktiv lungesykdom (KOLS), søvnapne og Covid-19 [8]. KOLS er en kronisk inflammatorisk lungesykdom karakterisert av ufullstendig respirasjon, grunnet progressive obstruksjoner i lungene. Den unormale inflammatoriske responsen er relatert til skadelige gasser eller partikler som blir aspirert ned i lungene [9]. Periodontitt og KOLS er begge kroniske og progressive inflammatoriske sykdommer som fører til en protolytisk destruksjon av bindevev [10]. Studier viser at sannsynligheten for å utvikle KOLS økte med alvorligheten av periodontal sykdom [11]. Sykdommene deler mange av de samme risikofaktorene: røyking, mikrobielle infeksjoner, diabetes, sosioøkonomisk status og dårlig munnhygiene [9][12]. Eliminering av periodontale bakterier gjennom systematisk periodontal behandling har ført til forbedret lungefunksjon og redusert risiko for eksaserbasjoner [13][14]. Det vil være vanskelig å generalisere studier som viser sammenheng mellom periodontitt og KOLS til hele befolkningen ettersom lungesykdommen kan ha vært en faktor i utviklingen av periodontal sykdom. En befolkningsstudie fra 2018 viste imidlertid at dårligere periodontal helse også var assosiert med økt luftveisobstruksjon hos en ung, frisk populasjon [15]. Andre epidemiologiske studier peker også på en assosiasjon til redusert lungevolum og økt risiko for luftveisobstruksjoner [16]. I en nylig publisert intervensjonsstudie utført ved Universitetet i Bergen ble lungefriske deltakere med mild periodontitt inkludert for å undersøke om periodontal behandling kunne ha en positiv effekt på lungefunksjonen. Studien viste tydelige forbedringer i lungefunksjonen parallelt med bedring i periodontal status gjennom det ettårige behandlingsforløpet [17].
Det primære formålet med denne tverrsnittstudien er å undersøke om det er en sammenheng mellom selvrapportert lungehelse og periodontal status blant pasienter som behandles for periodontitt ved Institutt for Klinisk Odontologi (IKO), UiB. Nullhypotesen er at det ikke er en sammenheng mellom selvapportert lungehelse og periodontal status.
Materiale og metode
Det var frivillig å delta i studien og alle deltagere har samtykket og signert en skriftlig samtykkeerklæring. Prosjektet er godkjent av Regionale Komiteer for medisinsk og helsefaglig forskningsetikk (REK vest 2023-551883).
Studiepopulasjon
Voksne pasienter diagnostisert med periodontitt og som mottok behandling for periodontitt ved IKO ble forespurt å delta i studien. Pasienter som samtykket, fikk tilsendt et elektronisk spørreskjema via SurveyXact som kartla lungehelse. Det ble sendt ut en purring etter to uker. Fra deltagere som besvarte spørreundersøkelsen ble journalopplysninger om periodontal status hentet ut fra pasientjournal (Opus journalsystemer).
Inklusjonskriterier:
Signert samtykkeerklæring
Pasienter 25-75 år med diagnosen periodontitt
Pasienter som får periodontal behandling enten ved student- eller spesialistklinikken på IKO
Eksklusjonskriterier:
Regelmessig sigarettrøking siste fem år
Diagnostisert KOLS
Diagnostisert lungekreft
Pågående kreftbehandling
Graviditet
Datainnsamling
Gjennom et validert spørreskjema ble pasientenes lungehelse kartlagt [15][18]. Oppsummert ble det stilt spørsmål knyttet til pipelyder i bryst, tung pust, hoste, persisterende slim, neseplager og sykdommer som astma og Covid-19. Det ble også spurt om pasientenes sosiale situasjon, tannhelse, tobakkvaner og fysisk aktivitet.
Fra pasientjournal ble det hentet ut informasjon om pasientenes kjønn, alder, diabetes (ja/nei) og om bruk av tannprotese. Det ble også samlet inn data om periodontale parametere og om periodontitt diagnose. Undersøkelse, diagnostikk og behandling ble på IKO utført av studenter eller tannleger under spesialisering, og deretter kvalitetssikret av erfarne instruktørtannleger. Alle studenter følger samme undersøkelses- og behandlingsprosedyre, og periodontale registreringer registreres i Opus pasientjournal.
Periodontale parametere som ble hentet ut fra journal:
Antall tenner (utenom 8`ere) og dentale implantater
Periodontitt diagnose, stadium og grad [19]
Plakkprosent (PI) registrert som prosent tannflater med synlig plakk etter plakkinnfarging [20]
Blødningsprosent (BI) registrert som prosent tannflater med blødning etter sondering [21]
Periodontal lommedybde ≥ 4 mm målt manuelt med periodontal lommedybdemåler (PCP278, Hu-Fridey, Chicago, IL, USA)
Styrkeberegning
For å undersøke styrken for de statistiske testene basert på 70 inkluderte pasienter ble det utført post-hoc styrke beregning. Denne beregningen viste at for å oppnå en styrke på 80 % for sammenhengen mellom piping i brystet og sykdomsfase trenger man å inkludere 69 pasienter, mens for oppvåkning ved tung pust vil 81 pasienter være tilstrekkelig.
Statistisk analyse
Datamaterialet ble først overført til Excel og deretter til R version 4.2.3 (R Foundation for Statistical Computing, Vienna, Austria). Kontinuerlige data ble oppgitt som gjennomsnittsverdier og standardavvik (SD). Kategoriske variabler ble oppgitt i frekvens og prosent. Sammenlikning av grupper ble gjort med tosidige T-tester for kontinuerlige variabler og Kji-kvadrat tester for kategoriske variabler. Videre ble assosiasjon mellom respiratoriske symptomer og periodontitt undersøkt med logistiske regresjonsanalyser hvor det ble beregnet odds ratio (OR) og 95 % konfidensintervall (KI). P-verdier mindre enn 0,05 ble betraktet som statistisk signifikante
Resultat
Totalt samtykket 142 pasienter til deltakelse (figur 2). Av disse var det 58 som ikke besvarte spørreskjema, og 14 deltakere ble ekskludert grunnet eksklusjonskriterier. Det ble hentet ut journaldata fra 70 pasienter som oppfylte inklusjonskriteriene til studien. Gjennomsnittsalderen på populasjonen var 62,0 år, og 52,9 % var menn (tabell 1). Gjennomsnittlig kroppsmasseindeks (KMI) var 27,8 og 73,9 % var i fysisk aktivitet minst 2–3 ganger i uken. Totalt var 54,0 % tidligere røykere, mens 7,2 % brukte snus eller e-sigaretter. Majoriteten (68,6 %) av populasjonen var ikke i inntektsgivende arbeid.
Figur 2
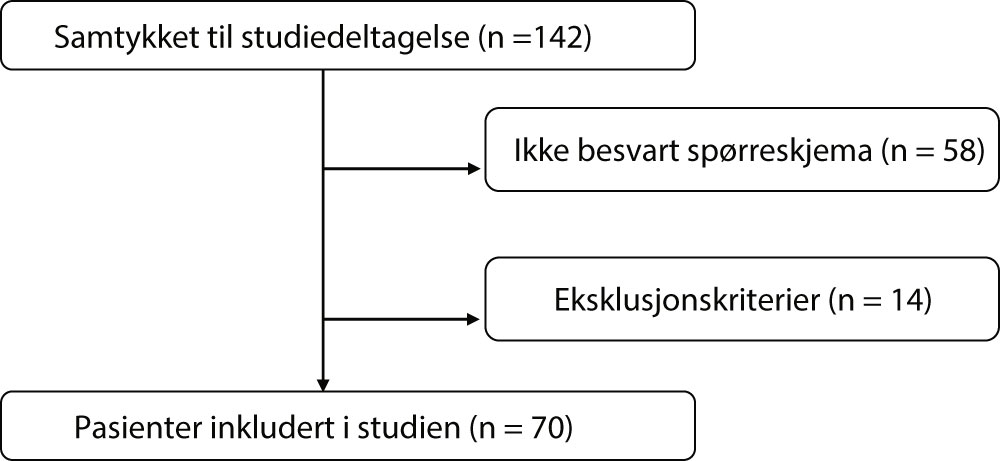
Figur 2. Flytskjema av studiedeltagere.
Kartlegging av orale og periodontale parametere er beskrevet i Tabell 2. Størsteparten av studiedeltakerne hadde periodontitt i stadium III eller IV (80,0 %) og i grad B (77,1 %). Gjennomsnittlig PI for pasientgruppen var 27,1 % og tilsvarende var BI 20,9 %. På spørsmål om hvor ofte man pusser tennene svarte 85,7 % at de pusset tenner to eller flere ganger om dagen. Et flertall av pasientene (65,7 %) var i behandling i trinn 4 (periodontal vedlikeholdsbehandling). Sammenlignet med pasientene i trinn 4, hadde pasientene i aktiv periodontal behandling (trinn 1-3) signifikant dypere periodontale lommer (p=0,015). Det var ikke signifikante forskjeller i antall tenner mellom de to behandlingsgruppene (p= 0,344) (ikke vist i tabell). Tre av pasientene var protesebærere (68-71 år), hvorav en var i behandlingstrinn 1-3. Alle hadde diagnosen periodontitt stadium IV og antall tenner var respektivt 10, 13 og 18.
Opplysninger om pasientene sin lungehelse er rapportert i Tabell 3. På spørsmål om respiratoriske symptomer svarte 27,1 % at de hadde oppspytt eller problemer med å få opp slim, og 22,9 % oppga at de hadde våknet med følelsen av å være tungpusten de siste 12 månedene. Pipelyder i brystet var opplevd av 59,1 % av deltagerne de siste 12 månedene, mens 27,3 % hadde hatt pipelyder i brystet de siste tre dagene. Med tanke på sykdommer som kan påvirke lungehelsen oppga 61,4 % av pasientene at de hadde gjennomgått Covid-19 infeksjon, og 22,9 % hadde astma
Tabell 4 beskriver assosiasjonen mellom respiratoriske symptomer og periodontale parametere. Det ble funnet statistisk signifikante sammenhenger mellom selvrapportert blødning ved tannpuss og respektivt å våkne med følelsen av å være tungpusten det siste året (p<0,001), å ha opplevd pipelyder i brystet det siste året (p=0,023) og å ha våknet med anfall av hoste det siste året (p=0,038). Det var signifikant flere pasienter i behandlingstrinn 1-3 enn i trinn 4 som respektivt hadde våknet med tung pust de siste 12 månedene (p= 0,007) eller hatt pipelyder i brystet det siste året (p=0,003). I tillegg hadde pasienter som våknet tungpusten det siste året signifikant høyere BI (p=0,013) og høyere PI (p=0,010) enn pasientene som ikke hadde våknet tungpusten.
Tabell 5 viser logistiske regresjonsanalyser justert for kjønn og alder mellom respiratoriske symptomer og periodontale parametere. Sammenlignet med pasienter i trinn 4 (periodontal vedlikeholdsbehandling), hadde pasienter i behandlingstrinn 1-3 signifikant høyere risiko for å våkne med følelsen av å være tungpusten (OR=5,38, KI 1,63; 19,60) og signifikant høyere risiko for å ha opplevd pipelyder i brystet (OR=8,30, KI 2,10; 40,50). Pasienter med blødningsprosent ≤ 20 % hadde signifikant mindre risiko for å våkne med tung pust sammenlignet med pasienter med blødningsprosent >20 % (OR=0, 27, KI 0,08; 0,87). I tillegg hadde menn >65 år signifikant høyere risiko for å ha våknet med anfall av hoste det siste året sammenlignet med kvinner (OR=3,42, KI 1,18; 10,7, p= 0,027), (ikke vist i tabell).
Diskusjon
Denne studien undersøkte sammenhengen mellom selvrapportert lungehelse og periodontitt hos pasienter ved UiB. Det ble ikke funnet en sammenheng mellom lungehelse og alvorligheten av periodontitt, men derimot rapporterte pasienter i aktiv periodontal behandling (trinn 1-3) at de oftere våknet tungpustet sammenlignet med pasienter i vedlikeholdsbehandling (trinn 4). Det ble også funnet en sammenheng mellom å våkne tungpustet og indikatorer for periodontal inflammasjon (BI) og periodontal infeksjon (PI), og selvrapportert blødning ved tannpuss. Pasienter i aktiv periodontal behandling rapporterte oftere pipelyder fra brystet sammenlignet med pasienter i vedlikeholdsbehandling. Det var også en sammenheng mellom pipelyder i brystet og selvrapportert gingival blødning fra tannkjøttet ved tannpuss.
Studien fant ingen sammenheng mellom alvorlighet av periodontitt (stadium og grad) og lungehelse selv om flere tidligere studier har observert en slik sammenheng [16][23]. Årsaken kan være mangel på distribusjon av pasienter i ulike stadium i denne studien. Hele 74,3 % av pasientene var diagnostisert med periodontitt stadium III og 77,1 % av pasientene hadde grad B. Det høye antallet av Grad B kan delvis forklares ved at røykere ble ekskludert fra studien. Røyking er den største risikofaktoren for utvikling, progresjon og alvorlighet av periodontitt. Røykere utgjør en stor andel av grad C pasienter, ettersom 10 røyk om dagen automatisk plasserer pasienten i grad C [19][24]. En annen årsak til stor forskjell i distribusjon av pasienter med forskjellig periodontal gradering kan forklares med en overvekt av deltagende pasienter var i vedlikeholdsfasen (65,7 %), hvor det gjerne foreligger større periodontal infeksjonskontroll og dermed tregere progresjon av sykdommen.
Det ble funnet signifikante sammenhenger mellom ulike periodontale behandlingsfaser (trinn 1-3 og trinn 4), pipelyder i brystet og følelsen av å våkne med tung pust det siste året. Det overordnede målet med behandling i trinn 1-3 er å eliminere den aktive infeksjonen i periodontiet og å oppnå periodontal helse [25], selv om dette kan være et urealistisk behandlingsmål for flere pasienter [26]. Dette betyr at pasienter som går over i trinn 4 generelt har mindre aktiv inflammasjon, noe som også var tilfelle for pasientene i denne studien. Studiens funn forsterker dermed teorien om at periodontal behandling kan ha positiv innvirkning på lungehelse. En randomisert kontrollstudie av Zhou et al. så på hvordan periodontal behandling ville påvirke lungefunksjonen hos KOLS pasienter (14). Studien viste at pasienter med periodontitt fikk økt Forced Expiratory Volume in 1 second (FEV1), færre eksaserbasjoner og saktere progresjon av KOLS etter behandling med scaling, rotplanering og grundig hygieneinstruksjon.
Gingival blødning er en viktig parameter som har blitt sett i sammenheng med lungehelse [27]. I vår studie ble både selvrapportert gingival blødning ved tannpuss og klinisk registrert blødning ved sondering registrert, og det ble funnet statistiske signifikante assosiasjoner mellom å våkne tungpusten og begge disse blødningsparameterne. I tillegg ble det funnet en assosiasjon mellom pipelyder i brystet og selvrapportert gingival blødning. En populasjonsbasert studie fra Nord-Europa så på assosiasjonen mellom lungefunksjon og selvrapportert gingival blødning ved tannpuss. Det ble funnet statistisk signifikant assosiasjon mellom selvrapportert KOLS, astma og gingival blødning [27]. Gingival blødning og blødning ved sondering gir et bilde på aktiv inflammasjon i tennenes festeapparat, men kan også gi en indikasjon på biofilmakumulering [28]. Mer gingival blødning og blødning ved sondering kan tyde på høyere bakterielt trykk som kan bli aspirert ned i lungene. Ved inflammasjon aktiveres angiogenese, og vi får tilvekst av gingivale kar. Endotelcellene blir mer permeable, og terskelen for at bakterier kan diffundere inn i blodbanen blir derfor lavere. Bakterier og lipopolysakkarider kan deretter interagere med leukocytter i systemisk sirkulasjon for så å sette i gang en systemisk inflammasjon. Økte CRP-verdier har blitt knyttet til nedsatt lungefunksjon og raskere nedgang av FEV1 hos individer [2].
Studien fant også en signifikant sammenheng mellom å ha våknet tungpusten de siste 12 månedene og mengde plakk. Plakkprosent kan gi en indikasjon på munnhygienen til pasienten, og noe forskning viser at dårlig plakkontroll kan gi økt risiko for flere lungesykdommer slik som astma og KOLS [29]. Man skal være oppmerksom på at plakkprosent måles på et gitt tilfeldig tidspunkt, og en kan ikke vite om pasienten har pusset ekstra godt før tannlegebesøket. I tillegg mangler informasjon om munntørrhet hos pasientgruppen, noe som kan påvirke akkumulering av dentalt plakk. Den bør derfor sees i sammenheng med BI, da denne verdien påvirkes mindre av atypisk plakkfjerning. Det har tidligere blitt foreslått at dentalt plakk kan inneholde stabile reservoar med respiratoriske patogener [30]. I en studie gjort på 138 eldre pasienter ble denne teorien bekreftet [31]. De fant at 64,5 % av pasientene hadde respiratoriske patogener kolonisert i det dentale plakket, og konkluderte med at dentalt plakk må bli sett på som en risikofaktor for kolonisering og aspirasjon av respiratoriske patogener, spesielt hos den eldre befolkningen. Dette underbygges av den tidligere nevnte studien til Zhou et al. som fant signifikant sammenheng mellom kun supragingival rens og forbedret lungefunksjon, samt færre eksaserbasjoner hos pasienter med KOLS [14]. En annen studie, som inkluderte over 100 KOLS-pasienter, viste at periodontal behandling resulterte i signifikant færre eksaserbasjoner sammenlignet med gruppen som ikke mottok behandling [32]. Selv om disse intervensjonsstudiene er utført på pasienter med KOLS, indikerer funnene en nær sammenheng mellom oral helse og sentrale indikatorer for lungesykdom. God munnhygiene og supragingival rens kan derfor være et kostnadseffektivt tiltak for å forebygge lungesykdom, og særlig nyttig for pasienter med etablert lungesykdom.
Studien har og hatt til hensikt å hente ut informasjon om avtagbare protesers mulige innvirkning på lungehelsen, men ettersom kun 5 % av pasientene i studien hadde avtagbare proteser fant man ingen korrelasjon mellom proteser og lungehelse. Tanken bak dette er at proteser kan skape endringer i den bakterielle sammensettingen i munnen, som igjen kan bli aspirert og påvirke lungehelsen. Endringen i mikrofloraen oppstår både fordi protesene er av kunstig materiale hvor plakk lettere kan adherere og fordi proteser kan påvirke mastikasjonen, spyttproduksjonen og oral clearance. En studie av individer som fikk utdelt sine første partielle proteser viste både øking av patogene bakterier og reduksjon av helsefremmende bakterier i munnhulen [32]. I litteraturen finner vi studier som har funnet sammenhenger mellom avtagbare proteser og lungeobstruksjoner. En pasient-kontroll-studie av Kelly et.al fant at pasienter med avtagbare proteser hadde lavere FEV1 enn kontrollgruppen uten avtagbare proteser [33]. Bruk av proteser var også assosiert med større risiko for moderat til alvorlig luftveisobstruksjon.
Styrken til denne studien er eksklusjon av røykere og pasienter med alvorlig lungesykdom. Dette betyr at pasientene hadde ganske like forutsetninger ved deltagelse i studien. En annen styrke er at det ble hentet ut fullverdige periodontale data fra pasientjournal, inkludert periodontal diagnose, BI og PI i samme tidsrom som validerte spørsmål fra spørreskjemaet ble besvart. En svakhet ved studien er at de periodontale undersøkelsene har blitt utført av forskjellige studenter og kontrollert av forskjellige instruktørtannleger. Selv om diagnoser og periodontale registreringer ble kontrollerte av erfarne klinikere, er ikke instruktørtannlegene interkalibrerte operatører. Studien har heller ikke klart å rekruttere ønskelig antall pasienter for å oppnå en tilfredsstillende styrke. Ettersom behandlingen blir utført på en studentklinikk får pasientene rabatterte priser, men lengre behandlingstid. Dette er trolig gunstig for pasienter med dårligere økonomi eller med mye tid til disposisjon og medfører en seleksjonsbias. Sosioøkonomisk status og alder er risikofaktorer for både periodontitt og nedsatt lungehelse, og en kan anta at dette kan påvirke resultatene i studien til en viss grad [9][34]. I tillegg er data om lungehelsen hentet ut fra et selvrapportert spørreskjema som trolig kan tolkes ulikt av pasientene. Ideelt bør sammenhengen mellom lungehelse og periodontitt ikke studeres i en tverrsnittsstudie, men gjennom en klinisk intervensjonsstudie som undersøker effekten av periodontal behandling på lungehelse.
Konklusjon
Det ble funnet sammenhenger mellom blødnings- og plakkprosent og selvrapportert lungehelse, men studien viste ikke en sammenheng mellom selvrapporterte symptom på lungesykdom og periodontitt (stadium og grad). Periodontittpasienter som var i periodontal vedlikeholdsbehandling våknet sjeldnere med tung pust og opplevde sjeldnere pipelyder i brystet sammenlignet med i pasienter i aktiv periodontal behandling. I tillegg var selvrapportert gingival blødning ved tannpuss assosiert med å våkne med tung pust og å ha pipelyder i brystet. Funnene styrker en hypotese om at periodontal behandling kan ha positiv effekt på lungehelse.
Takk
Professor Stein Atle Lie for hjelp til statistiske analyser og til medstudenter som tok seg tid til å levere ut samtykkeskjema til studiedeltakere.
Referanser
Herrera D, Sanz M, Shapira L, Brotons C, Chapple I, Frese T, et al. Association between periodontal diseases and cardiovascular diseases, diabetes and respiratory diseases: Consensus report of the Joint Workshop by the European Federation of Periodontology (EFP) and the European arm of the World Organization of Family Doctors (WONCA Europe). J Clin Periodontol. 2023;50(6):819-41.
Rasmussen F, Mikkelsen D, Hancox RJ, Lambrechtsen J, Nybo M, Hansen HS, et al. High-sensitive C-reactive protein is associated with reduced lung function in young adults. Eur Respir J. 2009;33(2):382-8.
Sethi S, Murphy TF. Bacterial infection in chronic obstructive pulmonary disease in 2000: a state-of-the-art review. Clin Microbiol Rev. 2001;14(2):336-63.
Hajishengallis G. Interconnection of periodontal disease and comorbidities: Evidence, mechanisms, and implications. Periodontol 2000. 2022;89(1):9-18.
Charlson ES, Bittinger K, Haas AR, Fitzgerald AS, Frank I, Yadav A, et al. Topographical continuity of bacterial populations in the healthy human respiratory tract. Am J Respir Crit Care Med. 2011;184(8):957-63.
Vilela MC, Ferreira GZ, Santos PS, Rezende NP. Oral care and nosocomial pneumonia: a systematic review. Einstein (Sao Paulo). 2015;13(2):290-6.
Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015;15(1):30-44.
Molina A, Huck O, Herrera D, Montero E. The association between respiratory diseases and periodontitis: A systematic review and meta-analysis. J Clin Periodontol. 2023;50(6):842-87.
Yang W, Li F, Li C, Meng J, Wang Y. Focus on Early COPD: Definition and Early Lung Development. Int J Chron Obstruct Pulmon Dis. 2021;16:3217-28.
Noguera A, Batle S, Miralles C, Iglesias J, Busquets X, MacNee W, et al. Enhanced neutrophil response in chronic obstructive pulmonary disease. Thorax. 2001;56(6):432-7.
Takeuchi K, Matsumoto K, Furuta M, Fukuyama S, Takeshita T, Ogata H, et al. Periodontitis Is Associated with Chronic Obstructive Pulmonary Disease. J Dent Res. 2019;98(5):534-40.
Hobbins S, Chapple IL, Sapey E, Stockley RA. Is periodontitis a comorbidity of COPD or can associations be explained by shared risk factors/behaviors? Int J Chron Obstruct Pulmon Dis. 2017;12:1339-49.
Kucukcoskun M, Baser U, Oztekin G, Kiyan E, Yalcin F. Initial periodontal treatment for prevention of chronic obstructive pulmonary disease exacerbations. J Periodontol. 2013;84(7):863-70.
Zhou X, Han J, Liu Z, Song Y, Wang Z, Sun Z. Effects of periodontal treatment on lung function and exacerbation frequency in patients with chronic obstructive pulmonary disease and chronic periodontitis: a 2-year pilot randomized controlled trial. J Clin Periodontol. 2014;41(6):564-72.
Perez Barrionuevo AM, Gomez Real F, Igland J, Johannessen A, Omenaas E, Franklin KA, et al. Periodontal health status and lung function in two Norwegian cohorts. PLoS One. 2018;13(1):e0191410.
Chen H, Zhang X, Luo J, Dong X, Jiang X. The association between periodontitis and lung function: Results from the National Health and Nutrition Examination Survey 2009 to 2012. J Periodontol. 2022;93(6):901-10.
Røsland A, Bertelsen RJ, Heinrich J, Lie SA, Malinovschi A, Bunæs DF. Effect of periodontal therapy on lung function: a twelve-month follow-up intervention study. Respir Res. 2025;26(1):172.
Svanes C, Johannessen A, Bertelsen RJ, Dharmage S, Benediktsdottir B, Bråbäck L, et al. Cohort profile: the multigeneration Respiratory Health in Northern Europe, Spain and Australia (RHINESSA) cohort. BMJ Open. 2022;12(6):e059434.
Caton JG, Armitage G, Berglundh T, Chapple ILC, Jepsen S, Kornman KS, et al. A new classification scheme for periodontal and peri-implant diseases and conditions - Introduction and key changes from the 1999 classification. J Periodontol. 2018;89 Suppl 1:S1-S8.
O'Leary TJ, Drake RB, Naylor JE. The plaque control record. J Periodontol. 1972;43(1):38.
Ainamo J, Bay I. Problems and proposals for recording gingivitis and plaque. Int Dent J. 1975;25(4):229-35.
Sanz M, Herrera D, Kebschull M, Chapple I, Jepsen S, Beglundh T, et al. Treatment of stage I-III periodontitis-The EFP S3 level clinical practice guideline. J Clin Periodontol. 2020;47 Suppl 22(Suppl 22):4-60.
Røsland A, Bertelsen RJ, Bunaes DF, Drengenes C, Engström G, Klinge B, et al. Periodontitis is associated with airflow obstruction in the Malmö Offspring Dental Study. J Clin Periodontol. 2023.
Tomar SL, Asma S. Smoking-attributable periodontitis in the United States: findings from NHANES III. National Health and Nutrition Examination Survey. J Periodontol. 2000;71(5):743-51.
Haffajee AD, Socransky SS. Microbial etiological agents of destructive periodontal diseases. Periodontol 2000. 1994;5:78-111.
Rattu V, Raindi D, Antonoglou G, Nibali L. Prevalence of stable and successfully treated periodontitis subjects and incidence of subsequent tooth loss within supportive periodontal care: A systematic review with meta-analyses. J Clin Periodontol. 2023;50(10):1371-89.
Gómez Real F, Pérez Barrionuevo L, Franklin K, Lindberg E, Bertelsen RJ, Benediktsdóttir B, et al. The Association of Gum Bleeding with Respiratory Health in a Population Based Study from Northern Europe. PLoS One. 2016;11(1):e0147518.
Caton JG, Armitage G, Berglundh T, Chapple ILC, Jepsen S, Kornman KS, et al. A new classification scheme for periodontal and peri-implant diseases and conditions - Introduction and key changes from the 1999 classification. J Clin Periodontol. 2018;45 Suppl 20:S1-s8.
Dong J, Li W, Wang Q, Chen J, Zu Y, Zhou X, et al. Relationships Between Oral Microecosystem and Respiratory Diseases. Front Mol Biosci. 2021;8:718222.
Garibaldi RA, Brodine S, Matsumiya S. Infections among patients in nursing homes: policies, prevalence, problems. N Engl J Med. 1981;305(13):731-5.
Sumi Y, Miura H, Sunakawa M, Michiwaki Y, Sakagami N. Colonization of denture plaque by respiratory pathogens in dependent elderly. Gerodontology. 2002;19(1):25-9.
Zhu X, Wang S, Gu Y, Li X, Yan H, Yan H, et al. Possible variation of the human oral bacterial community after wearing removable partial dentures by DGGE. World J Microbiol Biotechnol. 2012;28(5):2229-36.
Kelly N, Gormley K, Linden DA, Winning L, McClory M, Lundy FT, et al. The association of denture wearing with reduced lung function and increased airflow limitation in 58-72 year old men. PLoS One. 2023;18(5):e0285117.
Borrell LN, Crawford ND. Socioeconomic position indicators and periodontitis: examining the evidence. Periodontol 2000. 2012;58(1):69-83.
English summary
English summary
The association between periodontitis and lung health
Nor Tannlegeforen Tid. 2025; 135: 544-52.
DOI: 10.56373/6842d6fadcf77
Aim: To explore the association between self-reported lung health and periodontitis in adults
Methods: Non-smoking adult periodontitis patients who received periodontal therapy at the Dental Clinic at the University of Bergen, were invited to participate. Lung health was mapped by a validated electronic questionnaire, and information of periodontal status and periodontal therapy was obtained from the patient’s dental records. Associations between lung health and periodontal parameters were explored using T-tests, chi-square tests and logistical regression analysis.
Results: In total, 65.7 % of the patients received supportive periodontal care (step 4). Waking up short of breath was significantly associated with BI (p=0.013) and PI (p=0.010). Compared with patients in step 4, significantly more patients undergoing active periodontal therapy (step 1-3) reported waking up short of breath during the last 12 months (p=0.007) or having wheezing sounds in the chest during the last 12 months (p=0.003). Furthermore, patients in step 4 therapy had a 5.38 times greater odds ratio for waking up short of breath compared to patients in step 1-3.
Conclusion: An association was found between waking up being short of breath and increased periodontal inflammation and infection. Furthermore, patients in active treatment more often reported waking up being short of breath. This could indicate that oral bacteria affect the respiratory epithelium, and that periodontal treatment has a positive effect on the patient’s lung health.
Akseptert for publisering 13.05.2025. Artikkelen er fagfellevurdert.
Artikkelen siteres som:
Brenne ID, Fadnes LE, Røsland A, Bunæs DF. Sammenheng mellom selvrapportert lungehelse og periodontitt. Nor Tannlegeforen Tid. 2025;135:544-52. doi:10.56373/6842d6fadcf77
