Et kritisk blikk på dokumentasjonen for bruk av (Amoxicillin + Metronidazol) i periodontien
Scaling og rotplanering (SRP) er grunnstammen i en vellykket periodontittbehandling. Likevel responderer en liten, men signifikant pasientgruppe lite på slik terapi. Studier tyder på at slike pasienter responderer bedre på en behandling hvor den mekaniske terapien kombineres med antibiotika. Litteraturen viser en økende interesse for antibiotika-kombinasjonen amoxicillin + metronidazol, til tross for at WHO og EU advarer mot slik praksis. Målet med denne studien var å kartlegge 1) hva litteraturen sier om valg av kombinasjonsterapi i behandlingen av periodontitt, 2) hvordan medikamentene er brukt, og 3) om mikrobiologisk diagnostikk var brukt som grunnlag for valget av antibiotika. Databasene Medline (OVID) og PubMed ble søkt for relevante, engelskspråklige «systematiske oversiktsartikler» publisert i tidsrommet januar 2005 til mai 2013. Tre oversiktsartikler, som inkluderte totalt 35 artikler, ble funnet. Disse ble studert i fulltekst.
Det ble så lagt til to viktige inklusjonskriterier; «oppfølgingstid 12 måneder» og «valg av antibiotika på basis av bakterieprøvesvaret». Det var kun 1 av de 35 artiklene som samtidig oppfylte disse tilleggskriteriene, men den hadde en annen feil i sin design som gjorde at den måtte ekskluderes, den også. Fremtredende funn var kort oppfølgingstid, få som hadde valgt antibiotika på grunnlag av mikrobiologi, stor variasjon i antibiotikaregimene i de forskjellige artiklene. De fleste konkluderte med at kombinasjonsterapi var overlegent andre antibiotikaregimer. Konklusjonen er at det kan se ut som de ulike studiene har vurdert SRP + kombinasjonsterapi som en behandlingspakke til alle pasienter, uavhengig av deres mikrobiologiske status, eller deres respons på SRP alene. En slik ukritisk bruk av SRP + kombinasjonsterapi fører til et overforbruk av antibiotika og tilsidesetter de generelle, internasjonale anbefalingene fra helsemyndigheter vedrørende bruk av antibiotika. Det er også uheldig at «systematiske oversiktsartikler», hvor feil metode synes å høre til dagsordenen, publiseres og blir brukt til å legitimere utbredt bruk av kombinasjonsterapi i behandlingen av periodontitt.
Kronisk marginal periodontitt er en immunologisk indusert destruksjon av periodontiet. Infeksjonen er initiert av bakterier i den subgingivale biofilmen (plakket), hvor det er påvist over 500 - 700 forskjellige bakteriearter (1). Blant disse anses en liten gruppe på 15 - 20 bakterier som de viktigste for utvikling og progresjon av periodontitt (2).
Scaling og rotplanering (SRP), med eller uten kirurgisk intervensjon, er grunnlaget for enhver vellykket behandling av periodontitt (3 - 7). Ved SRP reduseres bakterieantallet, og miljøbetingelsene i den subgingivale biofilmen endres. Teknikken har vist seg effektiv hos de fleste pasienter (8). Likevel responderer en liten, men signifikant pasientgruppe lite på denne standard behandlingen. Denne gruppen pasienter opplever i stedet vedvarende inflammasjon i og destruksjon av støttevevet (9 - 10) til tross for adekvat SRP, og god munnhygiene. Man har antatt at den manglende responsen på SRP skyldes tilstedeværelsen av spesielt patogene mikroorganismer. Dette blir gjerne forstått som en indikasjon for bruk av antibiotika som del av behandlingen (11). Når antibiotika først skal anvendes, har det vært generell enighet om at slike skal brukes i tillegg til SRP (12), ikke anvendes alene mot periodontal sykdom, og at valget av antibiotika skal gjøres på grunnlag av en bakteriell diagnose (11).
I periodontien brukes et fåtall antibiotikaregimer. Det mest brukte er i dag kombinasjonsterapi (KT) som består av metronidazol (MET) og amoxicillin (AMOX). Den synergistiske effekten man får ved denne kombinasjonen har vært kjent i lang tid (13). KT ble først introdusert i periodontien i 1989 av Winkelhoff og medarbeidere (14), hvor det var effekten mot Aggregatibacter actinomycetemcomitans (tidligere Actinobacillus actinomycetemcomitans) som var den man søkte. Siden da har KT i økende grad blitt integrert i periodontal behandling, ofte ved å erstatte andre antibiotika når tilleggsbehandling med antimikrobielle midler syntes indisert. Dette har medført at denne bredspektrede antibiotikakombinasjonen har fått økt popularitet, til tross for kunnskapen om at den subgingivale mikrobiota ved periodontitt hovedsakelig består av endogene, anaerobe bakterier, som alle er sensitive for MET alene (15). Økt popularitet av KT strider dessuten mot overordnede anbefalinger fra Verdens Helseorganisasjon (WHO) og Den Europeiske Unions (EUs) helseinstitusjoner (16 - 18). Med det mål å forebygge utvikling av resistente mikroorganismer har WHO og EU slått fast at 1) bruk av antibiotika generelt må reduseres til et minimum; 2) at smalspektrede antibiotika skal brukes som førstehåndspreparat; 3) at bredspektrede eller kombinasjoner av antibiotika bør unngås i sin helhet med unntak av alvorlige infeksjoner som ikke lar seg behandle på annen måte (17,18). Overvåkningsgruppen for global antibiotikaresistens (http://www.reactgroup.org/) hevder at utvikling av antibiotikaresistens i dag må betraktes som et miljøproblem på linje med klimaproblematikken.
Målet med denne studien var å undersøke hva som ligger bak populariteten KT har oppnådd i periodontien, spesielt ved å se på hva periodontal litteratur sier om valg av KT hos pasienter med periodontitt. Vi konsentrerte oss om de 10 siste års «systematiske oversiktsartikler» på området fordi de allerede hadde ekskludert studier med utilstrekkelig design, og fordi disse oversiktsartiklene ofte styrer utviklingen og bruken av kliniske behandlingsmetoder.
Materiale og metode
Litteratursøk
De elektroniske databasene Medline (OVID) og Pub Med ble brukt i søk etter «systematic reviews» (= systematiske oversiktsartikler). Søkeordene som ble brukt var «combination therapy» og «periodontitis or periodontal», «amoxicillin and metronidazole» og alle mulige kombinasjoner av disse. Kun systematiske oversiktsartikler (SOA) på engelsk fra 2005 og frem til mai 2013 ble inkludert i materialutvalget.
Primær evaluering av inkluderte artikler
Det ble funnet tre SOA (19 - 21) som passet til søkekriteriene (Figur 1). Disse oversiktsartiklene var publisert i velrennomerte tidsskrifter hvor de hadde gjennomgått strenge fagfellevurderinger før aksept og publikasjon.
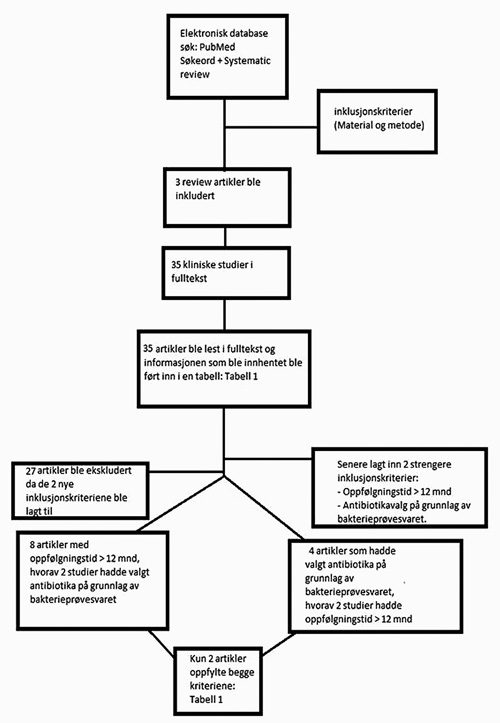
Figur 1. Flytdiagram for utvelgelse av artiklene.
Zandbergen et al (19) rapporterte 35 artikler (hvorav 28 ulike studier) med tilsynelatende akseptabel vitenskapelig og designmessig standard (se kriterier nedenfor). Disse 35 artiklene ble selektert blant 526 unike artikler fra velrennomerte tidsskrifter for evaluering av effektene av KT som tilleggsbehandling ved SRP i periodontal terapi. Bemerk at 491 (93.3 %) av artiklene ble forkastet pga utilstrekkelig vitenskapelig standard. Sgolastra og medarbeidere (20,21) identifiserte 368 unike artikler i et «systematic review» om KT i behandling av aggressiv periodontitt (20) og 517 titler i et ditto om KT i behandling av kronisk periodontitt (21), og inkluderte henholdsvis seks og fire studier i disse. Legg igjen merke til at Sgolastra og medarbeidere forkastet hhv 362 (98.4 %) (20) og 513 (99.3 %) (21) av studiene med begrunnelse at de var for dårlige til å kunne trekke konklusjoner. Noen av de inkluderte artiklene var listet i flere enn ett «systematic review», og da disse dublettene ble eliminert sto vi igjen med totalt 35 artikler for evaluering. Inklusjonskriteriene de ulike oversiktsartiklene (19 - 21) selv hadde satt ble også vurdert som akseptable - men ikke tilstrekkelige - av oss:
1: Randomiserte og ikke-randomiserte kontrollerte kliniske studier, prospektive kliniske og «Case-Control» studier.
2: Pasienter; Eldre enn 18 år; ingen kjente systemiske lidelser, ikke gravide, diagnostisert med ubehandlet lokalisert og generell aggressiv samt kronisk periodontitt (ikke behandlet for < 6 måneder); ikke medisiner de siste tre måneder som var kjent for å påvirke periodontal sykdom eller behandling av denne.
3: Intervensjon bestående av behandling med en kombinasjon av scaling og rotplanering + amoxicillin/ metronidazol (KT).
4: Primære kliniske parametere var lommedybder (PD) og klinisk festetap (CAL) Sekundære parametre; blødning ved sondering (BOP) og plakk (PI).
5: Oppfølgingstid minst 4 uker.
6: Data presentert ved hjelp av pre- og post-behandlede data.
Alle de inkluderte artiklene ble lest av tre av forfatterne (SAM, JA, HRP). Selekterte data ble registrert i en tabell (tabell 1) og gjennomgått for eventuelle feilregistreringer. Punkter som ble registrert i tabell 1 var følgende:
Referanse |
Type studie |
Mål |
Antall pas. |
Oppfølg. 12 mnd |
Mikrobiol diagnostikk Før valg av antib |
Klinisk utførelse |
Total antib. regime (mg) |
Når ab. ble startet |
Konklusjon |
|---|---|---|---|---|---|---|---|---|---|
Valenza et al 200922 |
Cohort, ublindet |
Undersøke forandringer av subgingival mikrobiota |
12 i en gruppe |
Ja. 24 mndr |
Nei |
Plakkfjerning (ikke SRP) over 2 økter innen 24 timer |
MET: 250 x 30 AMOX: 375 x 3 Tid: 7 dager Totalt: 13 125 |
Etter siste plakkfjerning |
Selv om det var gunstig klinisk resultat, var en midlertidig effekt observert kun på få bakteriearter |
Müller et al 199823 |
Cohort, ublindet |
Mulig å utrydde A.a. fra munnhulen? |
10 i en gruppe |
Nei |
Ja |
SRP på 2 - 4 økter. Ingen tidsramme |
MET: 400 x 3 AMOX: 500 x 3 Tid: 10 dager TOTALT: 27 000 |
6 uker etter SRP |
Sign. flere pas var neg for Aa etter endt undersøkelse |
Winkel et al 199824 |
Cohort, ublindet |
Klin + mikrobiol effekt av SRP +/- AMOX + MET v/ GKP |
22 i 2 grupper |
Nei |
Ja |
SRP over maks 6 timer. Ingen klar tidsramme, |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT: 13 250 |
Uklart. Et sted mellom 21 og 23 uker etter start |
SRP + AMOX/MET sign bedre enn SRP alene |
Silva et al 201125 |
Dobbelt blind, placebo RCT |
Effekt av SRP + MET versus SRP + MET/AMOX i ved GKP |
51 i 3 grupper |
Nei |
Nei |
SRP over 4 - 6 seanser i løpet av 21 dager |
MET: 400x3 AMOX: 500x3 Tid: 14 dager TOTALT 37 800 |
Etter første SRP seanse |
SRP + MET/AMOX sign bedre enn SRP+MET ved GKP |
Mestnik el al 201026 |
Dobbelt blind, placebo RCT |
Klin og mikrobiol effekt av SRP +/- MET/ AMOX ved GAP. |
30 i 2 grupper |
Nei |
Nei |
SRP over 6 seanser iløpet 14 dager |
MET: 400x3 AMOX: 500x3 Tid: 14 dager TOTALT: 37 800 |
Etter første SRP seanse |
SRP+AMOX/MET sign bedre enn SRP alene både klin og mikrobiol ved GAP |
Varela et al 201127 |
Dobbelt blind, placebo RCT |
Effekt av SRP +/- MET/AMOX i behandling av GAP |
35 i 2 grupper |
Nei |
Nei |
Behandlingen delt i 2 faser: |
MET: 250x3 AMOX: 500x3 Tid: 10 dager TOTALT 22 500 |
Etter SRP fase 1 |
SRP+AMOX/MET sign bedre enn SRP alene både klin og mikrobiol ved GAP i en kort periode på 3 mnd. Forskjellen fortapes etter 6 mndr |
Guerrero et al 200528 |
Dobbelt blind placebo RCT |
Effekt av SRP +/- SRP + MET/ AMOX ved GAP |
41 i 2 grupper |
Nei |
Nei |
1 dag SRP |
MET: 500x3 AMOX: 500x3 Tid: 7 dager TOTALT: 21 000 |
Etter første SRP seanse |
Sign forbedring (i en kort periode ) i kliniske parametere ved SRP+ AMOX/MET vs SRP |
Matarazzo et al 200829 |
Dobbelt blind, placebo RCT |
Klin og mikrobiol effekt av SRP, SRP + MET og SRP + AMOX/MET ved GKP |
43 i 3 grupper |
Nei |
Nei |
SRP i 4 - 6 seanser i løpet av 21 dager |
MET: 400x3 AMOX: 500x3 Tid: 14 dager TOTALT 37 800 |
Etter første SRP i 14 dager (SRP over21 dager) |
Sign bedre klin og mikrobiol etter SRP+MET/AMOX enn SRP + MET som igjen var bedre enn SRP alene |
Winkel et al 200130 |
Dobbelt blind, placebo RCT Parallel |
Klin og mikrobiol effekt av SRP +/-AMOX/MET |
49 i 2 grupper |
Nei |
Nei |
3 - 6 seanser. Ingen tidsramme |
MET: 250x3 AMOX: 375x3 Tid: 7 dager TOTALT: 13 125 |
6 uker etter SRP seansen |
Sign bedre effekt av SRP+ AMOX/MET enn SRP alene når antib gis i etterkant av SRP. |
Oliveira et al 201231 |
Dobbelt blind, placebo RCT paralell |
Endring i GCF cytokiner, etter SRP +/- AMOX/MET ved GAP |
55 i 2 grupper |
Nei |
Nei |
SRP over 4 - 6 seanser iløpet av 14 dager |
MET: 400x3 AMOX: 500x3 Tid: 14 dager TOTALT: 37 800 |
Ved første SRP seanse |
Sign forbedret cytokinprofil og GCF |
Casarin et al 201232 |
Dobbelt blind, RCT parallell |
Klin og mikrobiol effekt av SRP +/- AMOX/MET i ved GAP |
24 i 2 grupper |
Nei |
Nei |
SRP alle kvadranter i løpet av 45 min. Ufullstendig beskrivelse |
MET: 250x3 AMOX: 375x3 Tid: 7 dager TOTALT: 13 125 |
Ved behandling, sier ikke noe om starttidspunktet. |
Sign bedre SRP +MET/AMOX enn SRP alene, klinisk og mikrobiol resultat behandlingen av GKP |
Heller et al 201133 |
Dobbelt blind, placebo RCT parallell |
Klin og mikrobiol endring ved SRP +/- AMOX/MET ved GAP |
31 i 1 gruppe |
Nei |
Nei |
FMD etter flere protokoller; usammenhengende forklart |
MET: 250x3 AMOX: 500x3 Tid: 10 dager TOTALT: 21 500 |
Etter siste økt med FMD |
Sign bedre mikrobiol resultat ved FMD+AMOX/MET intil 6 mndr etter behandling |
Cionca et al 201034 |
Dobbelt blind, placebo RCT paralell |
Effekt av SRP +/- AMOX+ MET ved GKP |
51 i 2 grupper |
Nei |
Nei |
2? Seanser i løpet av 24 timer |
MET: 500x3 AMOX: 375x3 Tid: 7 dager TOTALT: 18 375 |
Etter siste SRP |
Sign bedre effekt av SRP + AMOX/MET |
Cionca et al 200935 |
Dobbelt blind, placebo RCT parallell |
Evaluere AMOX/MET rett etter fullført FMD hos pas med GKP |
51 i 2 grupper |
Nei |
Nei |
2(?) økter innen 48 timer |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT: 13 125 |
Etter siste SRP |
Sign bedre med AMOX/MET gitt etter SRP vs SRP alene |
Del Peloso Ribeiro et al 200936 |
Dobbelt blind, placebo RCT paralell |
Effekt av SRP +/- AMOX/MET ved alvorlig GKP |
25 i 2 grupper |
Nei |
Nei |
SRP i alle kvadranter innen 45 min. 1 dag? Utilstrekkelig beskrivelse |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT 13 125 |
Etter siste SRP |
SRP+AMOX/MET bedre enn SRP alene, dog var forskjellen liten. |
Johnson et al 200837 |
Retrospektiv studie |
Periodont patogener i vanskelig tilgjengelige steder etter SRP +/- AMOX/MET |
18 i 1 gruppe |
Nei |
Nei |
SRP over 2 økter innen 3 dager |
MET: 250 x 3 AMOX: 500 x 3 Tid: 7 dager TOTALT: 15750 |
Etter siste SRP |
Rekolonisering av behandlede overflater etter 6 mndr. Støtter hypotesen om utilgjengelige reservoirer av bakterier som gir residiv. |
Kaner et al 200738 |
Retrospektiv, parallell |
Evaluere tidspunkt for antib beh på GKP |
33 i 2 grupper |
Nei |
Nei |
SRP over 4 økter innen 2 uker |
MET: 250 x 3 AMOX: 500 mg x 3 Tid: 10 dager TOTALT: 21 500 |
Etter siste SRP (direkte etter og lenge etter) |
Sign bedre kliniske parametre ved å gi AMOX/MET direkte etter SRP. |
Guerrero et al. 2007 39 |
Retrospektiv |
Effekt av ufullstendig etterlevelse av foreskrevet antibiotika regime SRP+ AMOX/MET på GAP |
18 i 1 gruppe |
Nei |
Nei |
SRP over 4 økter på 1 time hver, innen 4 uker |
MET: 500 mg x 3 AMOX: 500 mg x 3 Tid: 7 dager TOTALT: 21 000 |
Etter siste SRP |
Ufullstendig 7-dagers SRP+ MET/AMOX er assosiert med redusert kliniske resultater hos pasienter med GAP |
Aimetti et al 201240 |
Dobbelt blind, placebo RCT paralell |
Effekt av SRP/FDIS +/- AMOX/MET ved GAP |
39 i 2 grupper |
Nei |
Nei |
SRP i 2 seanser i løpet av 24 timer |
MET: 500x3 AMOX: 500x3 Tid: 7 dager TOTALT: 21 000 |
Etter første SRP seanse |
Sign effekt av FDIS + MET/AMOX på klinisk og mikrobiol parametre ved behandling av GKP |
Goodson et al 201241 |
RCT, singel bllind |
Effekten av diverse varianter av SRP +/- AMOX/MET |
187 i 8 grupper |
24 mnd |
Nei |
SRP i 4 seanser i løpet av 4 uker |
MET: 250x3 AMOX: 500x3 Tid: 14 dager TOTALT 31 500 |
Etter første SRP seanse |
Sign bedre effekt av SRP+AMOX/MET i forhold til andre typer behandling |
Giannopoulou et al 200642 |
RCT, parallell, dobbelt-blind |
Effekt av mikrobiol diagnostikk på forutsigbarhet av SRP+/-AMOX/MET |
16 i 2 grupper |
12 mndr |
Nei |
SRP kun beskrevet som «grundig» |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT: 12 125 |
Etter SRP |
Utmerket resultat i grupper med antib var oppnådd uavhengig av tilstedeværelse eller fravær av seks klassiske periodontale patogener før behandling. |
Mombelli et al 200543 |
RCT, placebo ktr. studie |
Effekt av EMDOGAIN +/- AMOX/MET på regenerasjon etter periodontal behandling. |
16 i 2 grupper |
12 mndr |
Nei |
2 - 4 seanser med 1 ukes mellomrom |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT: 12 125 |
Etter SRP |
Støtter hyp om at AMOX/MET trengs for å undertrykke biofilmens negative effekt på regenerasjon |
Yek et al 201044 |
Parallell, singel blind |
Effekt av MET/AMOX på klin og mikrobiol parametre ved GAP. |
28 i 2 grupper |
Nei |
Nei |
SRP over 2 seanser. Ingen tidsramme |
MET: 500 x 3 AMOX: 500 x 3 Tid: 7 dager TOTALT: 21 000 |
«Under første SRP seanse» |
AMOX/MET + SRP fører til bedre klinisk tilheling enn ved med SRP alene. |
Van Winkelhoff et al 199245 |
Cohort, parallell ublindet |
Mikrobiol og klin effekter av SRP+/- AMOX/MET ved A.a. GAP |
118 i 3 grupper |
Nei |
Ja |
Nevnes ikke |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT: 13 250 |
Nevnes ikke |
SRP+ AMOX/MET er effektiv for subgingival suppresjon av A.a. hos pas med alvorlig periodontitt. |
Xajigeorgiou et al 2006 46 |
RCT |
Effekten av AMOX/MET, DOXY og MET på klin og mikrobiol parametere ved GAP. |
41 i 4 grupper |
Nei |
Nei |
SRP over 4 seanser. Ingen tidsramme |
MET: 500 x 3 AMOX: 500 x 3 Tid: 7 dager TOTALT 21 000 |
6 uker etter SRP |
Tilleggsbehandling med AMOX/MET eller MET alene (når A.a. ikke er tilstede) er effektiv i dype lommer hos pasienter med aggressiv periodontitt. |
Ehmke et al 200547 |
Parallell, singel blind |
Evaluere langtidseffekten av en spesifikk systemisk antimikrobiell behandling av GKP |
35 i 2 grupper |
24 mndr |
Nei |
SRP: 2 timer per kvadrant. Ingen tidsramme. SRP behandling utført av studenter |
MET: 250 x 3 AMOX: 375 x 3 Tid: 8 dager TOTALT: 15 000 |
Etter SRP |
SRP + AMOX/MET signifikant bedre enn SRP alene på lommer >>7mm. |
Berglundh et al 199848 |
RCT split mouth, Placebo |
Effekt av SRP +/- AMOX/MET ved GKP |
16 i 2 grupper |
24 mndr |
Ja |
SRP kun av halve munnen over 2 uker. 3 - 5 seanser. Halve munnen ingen SRP |
MET: 250 x 3 AMOX: 375 x 2 Tid: 14 dager TOTALT: 26 250 |
Under SRP behandling. Sier ikke når det blir startet |
SRP+AMOX/MET mer effektivt enn SRP alene ihht forbedring i kliniske parametere av peridontitt |
Flemming et al 199849 |
RCT parallell. |
Ingen klare mål nevnt. |
38 i 2 grupper |
12 måneder |
Nei |
SRP; 2 timer per kvadrant. Ingen tidsramme, men utført av studenter. |
MET: 250 x 3 AMOX: 375 x 3 Tid: 8 dager TOTALT: 15 000 |
Etter siste SRP |
SRP+AMOX/MET effektiv ved periodontitt + A.a. etter 12 mndr. Regimet kan gi negativt effekt på klinisk behandlingsresultat hos pasienter med P.g |
Ehmke et al 200350 |
RCT, Parallell, singelblind |
Effekt av SRP+/-AMOX/MET på progresjonav periodontitt etter behandling |
35 i 2 grupper |
24 mndr |
Nei |
SRP; 2 timer per kvadrant. Ingen tidsramme, men utført av studenter. |
MET: 250 x 3 AMOX: 375 x 3 Tid: 8 dager TOTALT: 15 000 |
Etter siste SRP |
SRP+AMOX/MET reduserte progresjon ved dype lommer, men mindre ved grunne. |
Moeintaghavi et al 200751 |
RCT parallell, dobbel-blind |
effekt av SRP+/- AMOX/MET på moderat til GKP |
50 i 2 grupper |
Nei |
Nei |
SRP over 1 seanse på 1 time |
MET: 250 x 3 AMOX: 500 x 3 Tid: 7 dager TOTALT: 15 750 |
«samme dag som SRP». Sier ikke når det starter |
SRP+AMOX/MET sign bedre enn SRP alene |
Baltacioglu et al 201152 |
Parallell |
Klinisk effekt av SRP+AMOX/ MET vs SRP + doxicycline på one day FDIS på GAP |
38 i 3 grupper |
Nei |
Nei |
FRP i løpet av en seanse |
MET: 250 x 3 AMOX: 250 x 3 Tid: 10 dager TOTALT 15 000 |
Etter FRP |
Både AMOX/MET og DOXY hadde tilleggseffekt ved beh av GAP, nok til å hindre bruk av kir. |
Rodrigues et al 201253 |
Cohort. ublindet |
Effekt av SRP+/- AMOX/MET på klin og mikrobiol ved AP |
12 i en gruppe |
Nei |
Nei |
SRP over 6 - 8 seanser, ingen tidsramme |
MET: 400 x 3 AMOX: 500 x 3 Tid: 7 dager TOTALT: 18 900 |
Etter biofilm-forstyrrelse; 45 dager etter SRP |
SRP+AMOX/MET førte god klin effekt , unntatt festetap, + signifikant reduksjon av subgingival Tf og Td. |
Aakincibay et al 200854 |
RCT |
effektene av SRP+DOXY og . SRP+AMOX/MET på elim av Aa + klin parametre |
30 i 2 grupper |
Nei |
Nei |
Mekanisk behandling: Utilstrekkelig beskrevet |
MET: 250 x 3 AMOX: 375 x 3 Tid: 7 dager TOTALT 13 125 |
«Samtidig som mekanisk behandling» |
SRP + DOXY eller MET/AMOX effektiv ved LA |
Machtei & Younis 200855 |
Cohort, parallell |
Effekt av SRP +/-AMOX/MET på klin og immunol parametre ved AP |
29 i 2 grupper |
Nei |
Nei |
SRP over 4 økter i 4 uker |
MET: 250 x 3 AMOX: 500 x 3 Tid: 14 dager TOTALT: 21 500 |
Samtidig som SRP, men sier ikke når det startet |
SRP +AMOX/MET bedre enn SRP alene, selv om begge ga god effekt |
Moreira & Feres-Filho 200756 |
RCT. Parallell, |
Effekt av SRP/AMOX +FDIS vs AMOX/MET + SRP v/ AP |
30 i 2 grupper |
Nei |
Nei |
Gruppe 1: SRP over 2 økter på 2 timer hver innen 24 timer Gruppe 2: SRP over 4 økter innen 2 uker |
MET: 250 x 3 AMOX: 500 x 3 Tid: 7 dager TOTALT 15 750 |
Etter første SRP økt |
Ingen forskjell mellom behandlingsstrategiene FDIS og SRP + AMOX/MET |
Forkortelser:
RCT = Randomized clinical trial, AMOX = Amoxicillin. MET = Metronidazol, GKP = Generalisert kronisk periodontitt ,GAP = Generell aggressiv periodontitt, LAP = Lokal aggressiv periodontitt, AP = Aggressiv periodontitt, FDIS= full mouth desinfection, SRP = Scaling & Rotplanering, LD = Lommedybde, Ab. = Antibiotika, A.a. = Actinobacillus /Aggregatibacter actinomycetemcomitans, P.g. = Porphyromonas gingivalis, T.f. = Tannerella forsythia, T.d.= Treponema denticola
1) Mål med studien. 2) Antall deltakere. 3) Oppfølgingstid. 4) Seleksjon på bakgrunn av mikrobiologi. 5) Klinisk beskrivelse. 6) Antibiotika regime. 7) Når antibiotika ble gitt i forhold til den mekaniske behandlingen. 8) Total antibiotika eksponering. 9) Konklusjon/kommentar.
Feil i design av studier kan medføre skjevheter («bias») i resultatene, feil konklusjoner og anbefalinger. Det er således viktig å eliminere eller redusere disse til et minimum ved å gjennomgå data systematisk og bruke korrekte teknikker for utvelgelse og intervensjon. Zandbergen og medarbeidere (19) brukte fem kriterier for å vurdere eventuell risiko for bias ved de inkluderte studiene. At studiene tilfredsstilte følgende kriterier:
1) Definerte kriterier for periodontitt; 2) Tilfeldig allokering til intervensjonsgrupper; 3) Var maskert for deltakerne (enkelt blind); 4) Var maskert for kontrolløren og deltagerne (dobbelt blind); 5) Rapporterte frafall av oppfølgning.
Lav risiko for bias ble vurdert dersom studien oppfylte alle kriteriene, mens det ble ansett som moderat risiko for bias dersom et av disse kriteriene ikke var oppfylt. Høy risiko for bias var det om tre eller flere av kriteriene ikke var oppfylt. Av de 28 inkluderte studiene (35 artikler) i artikkelen av Zandbergen et al (19) ble 15 vurdert med «lav risiko for bias» (22, 23 - 40), fem fikk vurderingen «moderat risiko for bias» (41,42,43,44 - 46), mens åtte av studiene ble ansett å ha «høy risiko for bias» (47 - 50,51 - 56).
Sgolastra og medarbeidere hadde syv kriterier for å vurdere risiko for skjevheter ved de studiene som ble inkludert i deres «systematic reviews» (20,21), og brukte samme kvalitetsvurdering og teknikk for utvalg i begge studier. Disse var:
1) Statistisk «styrkeberegning» 2) Randomisering og metoder for hemmeligholdelse. 3) Klar definisjon av inklusjons og eksklusjonskriterier; 4) Fullført kontroll med definering av frafall; 5) Forsøks- og kontrollgruppe sammenlignbare ved baseline; 6) Enkelt /dobbelt blinding; 7) Nøyaktige statistiske analyser.
Det ble oppgitt at faren for skjevheter ble vurdert ut fra hvor mange av deres kriterier studiene oppfylte. Identisk med Zandbergen et. al (19), ble lav risiko for bias estimert dersom alle kriteriene var oppfylt. Moderat og høy risikovurdering, på den annen side, fikk studiene dersom ett eller flere kriterier bare var delvis oppfylt, respektive dersom ett eller flere kriterier ikke var oppfylt (2).
Av de 6 inkluderte studiene i Zgolastra et al. (20) oversiktsartikkel om aggressiv periodontitt, tilfredsstilte fire (26 - 28,44) disse kriteriene. En studie (46) rapporterte ikke styrkeberegning, mens en annen (52) ikke tilfredsstilte kriteriene til styrkeberegning, randomisering eller blinding. Etter at forfatterne ble kontaktet, tilfredsstilte alle studiene deres kriterier utenom én (52) der kvalitetsvurderingen forble den samme. Fem av studiene ble derfor vurdert til å ha lav risiko, mens én studie ble vurdert til å ha høy risiko for bias (52).
I en systematisk oversiktsartikkel om kronisk periodontitt vurderte Sgolastra et al (21) to av de fire inkluderte studiene med lav risiko (13), mens de to siste (30,47) ble vurdert til å ha høy risiko for bias. Studiene med høy risiko for bias tilfredsstilte ikke to av kriteriene ved ikke å oppgi styrkeberegning og metode for randomisering. Forfatterkontakt ga ingen endring av denne vurdering.
Sekundær evaluering av de inkluderte artiklene
Da Zandbergen (19) og Sgolastras (20,21) inklusjonskriterier ble vurdert - av oss - på flere punkter å være uakseptabelt lave for kliniske studier, la vi selv inn strengere krav til inklusjon:
1) Observasjonstid etter behandling måtte være mer enn 12 måneder; 2) Valg av antibiotika (inklusjonskriterier) skulle være basert på mikrobiologisk diagnostikk.
Når de nye inklusjonskriteriene ble lagt til grunn, var det kun åtte studier som hadde en oppfølgingstid på 12 måneder (22,41 - 43,47 - 50), mens fire artikler hadde brukt mikrobiologisk diagnostikk som basis for valg av antibiotika (23,24,45,48). Kun én artikkel tilfredsstilte begge tilleggskrav (48). På den annen side hadde denne studien (48) et annet og uheldig design i og med at man hadde brukt split-mouth-teknikk, og det kan man ikke gjøre når man skal evaluere bruk av antibiotika ved periodontitt. Dette medfører at ingen artikler hadde den nødvendige vitenskapelige design for å kunne gi svar på spørsmålet om KT bør anvendes ved behandlingen av periodontal sykdom.
Diskusjon
Vi gikk ut fra systematiske oversiktsartikler (SOA) fordi disse, i velrennomerte tidsskrifter, legger grunnlaget for klinikeres bruk av informasjonen. Samtidig har disse studiene gått gjennom de fleste artikler på området, og forkastet det som ikke holder mål rent vitenskapelig og metodemessig. De 3 identifiserte SOA (19 - 21) var alle enige om at tilleggsbehandling med kombinasjonsterapi er fordelaktig for utfallet av behandling hos pasienter med generell kronisk (19,21) og aggressiv (20) periodontitt. Disse diagnosene omfatter det store flertall av periodontale sykdommer sett i en tannlege/spesialistpraksis. Det er her viktig å merke seg at det er 3 generelle kriterier som er av betydning for studienes kvalitet, som bør tas i betraktning før en endelig konklusjon blir trukket: Oppfølgingstid, kriterier for valg av antibiotika og den kliniske behandlingsstrategien.
Kort oppfølgingstid: De fleste av de 35 artiklene hadde en oppfølgingstid på 6 måneder eller kortere (tabell 1). Det kan i blant være relevant å vurdere en mikrobiologisk respons etter antibiotikabehandling i løpet av de første 6 månedene, men registrering av kliniske data før 12 måneder har derimot ingen verdi, selv om man kan observere lommedybdereduksjon rett etter behandling (57 - 59). En annen gjennomgående trend i disse 35 studiene, var det lave antallet pasienter i de inkluderte studiene (tabell1).
Kun 8 artikler hadde en oppfølgingstid på minst 12 måneder (22,41 - 43,47 - 50). Selv om flere av artiklene konkluderte med at det var kliniske fordeler ved bruk av kombinasjonsterapi, vet vi ikke noe om langtidseffekten med tanke på kliniske parametere og mikrobiologisk status, og det er jo dette som er av betydning for pasienten.
Seleksjonskriteriene for antibiotika: Bare 4 av de studiene som var inkludert i de tre systematiske oversiktsartiklene (23,24,45,48) valgte antibiotika basert på mikrobiologisk diagnostikk. WHO og EU (16 - 18) anbefaler at antibiotika bør velges med utgangspunkt i mikrobiologisk diagnostikk (60 - 61), og dette bør da også gjelde kliniske studier. Begrunnelsen for å bruke KT som et tillegg til mekanisk behandling er å angripe spesielt patogene bakterier, som f.eks. A. actinomycetemcomitans (14,62) som ikke er sensitive for enkle antibiotika (15). Imidlertid er de færreste periodontale infeksjoner karakterisert med tilstedeværelse av denne bakterien, og bruk av kombinasjonsterapi uten å ha en bakterieprøve som utgangspunkt for valget vil derfor uvegerlig generere et «overforbruk» (4,15). Dersom man ønsker å evaluere effekten av KT, trenger man en populasjon hvor alle har A. actinomycetemcomitans. Det analoge gjelder dersom man ønsker å studere effekten av MET, hvor en relevant studiepopulasjon ville bestått av pasienter med bakterier som er sensitive for MET og ekskludert de pasientene som hadde bakterier i sin subgingivale biofilm som var lite sensitive eller insensitive for dette antibiotikum. Som eksempel på en slik feil studiedesign viser vi til Silva et al (25) som sammenlignet SRP med SRP + MET og SRP + KT i behandling av kronisk periodontitt. Valg av antibiotika ble ikke gjort med utgangspunkt i mikrobiologisk diagnostikk. De konkluderte, som andre (26,40,44), med at tilleggsbruk av KT medførte kliniske og mikrobiologiske fordeler sammenlignet med SRP alene, mens fordelene av å bruke MET alene var mindre tydelige (25). Dette resultatet står i kontrast til en annen studie (63) hvor frekvensen av behandlingssuksess var signifikant høyere i gruppen som hadde fått behandling med SRP + MET alene, enn i gruppen som hadde fått SRP + placebo.
Det er ikke mulig å sammenligne disse to studiene da Silva et al (25) randomisert pasientene til gruppene uten å ta hensyn til mikrobiologisk diagnostikk. A. actinomycetemcomitans var diagnostisert i alle 3 grupper. Dette resulterte i at pasienter med MET-insensitiv flora (A. actinomycetemcomitans) ble behandlet med MET og dette kan være noe av forklaringen på hvorfor MET kom dårligere ut enn KT (25). I Preus et al (63) ble SRP+MET testet opp mot SRP alene. Pasienter som hadde A. actinomycetemcomitans og andre bakterier med resistens eller lav sensibilitet for MET ble ekskludert. Dette medfører at MET sin terapeutiske effekt var lik i alle grupper, noe den ikke var i Silva sin studie (25). I Preus' (63) studie ble 49 av 292 pasienter ekskludert da de hadde bakterier som enten var resistente eller hadde lav sensitivitet for MET (63), noe som tilsier at dersom KT hadde vært valget i denne studie, ville 83 % av pasientene blitt behandlet unødvendig med kombinasjonsterapi.
Behandlingsstrategien: De 35 artiklene (tabell 1) hadde alle svært forskjellige behandlingsstrategier, som varierte fra «full-mouth SRP» utført på 24 t til et SRP-regime med 6 økter som ble utført i løpet av en 3 ukers periode (tabell 1). Store variasjoner i KT- regimene fra studie til studie viste mer enn 10 forskjellige strategier (tabell 1) med et totalt forbruk av antibiotika (AMOX+MET) som varierte fra 12.125 mg til 37.800 mg. Den kliniske fremgangsmåten var også beskrevet i ulik, og ofte utilstrekkelig grad (tabell 1). Et annet viktig spørsmål var når antibiotika ble gitt i forbindelse med SRP, hvor det også ble påvist betydelig variasjon, men hvor ingen ga medikamentet før SRP. Noen få studier presiserte ikke når antibiotika ble gitt (tabell 1) i forhold til SRP.
Det er nettopp ved periodontale infeksjoner med innslag av spesielt patogene bakterier, som A. actinomycetemcomitans (14,61), at det kan være behov for å bruke KT som en tilleggsbehandling til SRP. De fleste periodontale infeksjoner er likevel ikke karakterisert ved tilstedeværelse av slike bakterier. Det kan se ut som de ulike studiene har vurdert SRP + KT som en behandlingspakke til alle pasienter, uavhengig av deres mikrobiologiske status, eller deres respons på SRP alene. En slik ukritisk bruk av SRP + KT fører som vist til et overforbruk, og overtrer de generelle internasjonale anbefalingene fra helsemyndigheten (16 - 18) om bruken av antibiotika for behandling av infeksjoner.
Det er verdt å legge merke til at da vi la inn to strengere inklusjonskriterier, hvorav ett av dem var oppfølgingstid 12 måneder, satt vi igjen med kun én artikkel (48), som faktisk ikke holdt designmessig mål den heller. Dette viser hvilke krav som stilles til publikasjon av kliniske studier. Det bør således understrekes at hele 488 artikler, fra velrennomerte tidsskrifter som J. Periodontol. og J. Clin. Periodontol. ikke hadde god nok vitenskapelig design til å bli inkludert i de tre «systematic reviews» som i sin tur gjennomgående hadde for svake inklusjonskriterier. Resultatet av at klinikere stoler på slike oversiktsartikler, hvor uheldige metoder er benyttet, kan bli å legitimere utbredt bruk av KT i behandlingen av periodontitt. Vår tro på «evidence based dentistry» har derfor fått et skudd for baugen av utilstrekkelige og dårlig designede kliniske studier, og enda verre - systematiske oversiktsartikler som notorisk gir feil anbefalinger basert på utilstrekkelige kriterier og dårlige studier.
Kliniske studier som omhandler antibiotika burde bli regulert, da det burde være en bedre seleksjonsprosess før bruk av antibiotika institueres. Ansvaret ligger hos forskerne, men også hos tidsskriftene som publiserer disse studiene. Vi vet at fasiliteter for mikrobiologisk diagnose ikke er tilgjengelig i mange land, og at betydningen av slik diagnose kan bli satt spørsmålstegn ved da diagnosen av en enkel prøve kan variere fra laboratorium til laboratorie og fra teknikk til teknikk. Likevel må disse argumenter ikke bli brukt til å legitimere bruken av antibiotika (inklusive KT) uten en forutgående mikrobiologisk diagnose. Det burde være et økt fokus på mikrobiologisk diagnose dersom antibiotikabehandling skal igangsettes. Dette vil gi et høyere ønske om slik tjeneste fra klinikerne, og kunne bidra til utvikling av nye og bedre laboratorier, teknikker og tolkninger. Slik vil vi kunne sikre et suksessfullt og forutsigbart behandlingsresultat for alle typer periodontittkasus, og dessuten etterkomme overordnede anbefalinger fra WHO og EU.
Kliniske vurderinger: Vi stiller spørsmåltegn ved om SRP + antibiotika i det hele tatt bør brukes som initial behandling av periodontitt. Da det hos de fleste pasienter er tilstrekkelig med SRP alene (3 - 8) for å oppnå behandlingssuksess, er det vanskelig å rettferdiggjøre bruken av antibiotika som en del av behandlingen.
Behandlingsstrategien bør være at man vurderer ulike faktorer som er av betydning for utfallet av periodontittbehandlingen. En bør først vurdere pasientens evne til plakkontroll. Er denne tilstrekkelig? Hvis ikke kan dette være årsaken til at SRP alene ikke gir tilfredsstillende resultat. Dersom plakkontrollen er god bør en vurdere om SRP har hatt optimal kvalitet. Antibiotika har ingen effekt i en pasient som ikke har meget god munnhygiene, må ikke brukes som substitutt for en utilstrekkelig SRP.
Ser man at plakkontrollen hos pasienten er optimal, samtidig som SRP-behandlingen er riktig utført bør man vurdere å ta en bakterieprøve. Svaret på bakterieprøven vil da gi en indikasjon på om antibiotika er indisert. Valg av antibiotika bør skje på grunnlag av bakterieprøvesvaret. Dersom pasienten fortsatt ikke responderer som forventet, kan dette skyldes en ikke diagnostisert systemisk sykdom eller annet. Pasienten bør da henvises til en lege for videre utredning (64).
Konklusjonen på denne studien er at det er en effekt av kombinasjonsterapi på periodontitt der A. actinomycetemcomitans er involvert, som i så måte er i tråd med den initale forståelse for bruk av kombinasjonsterapi (14). Imidlertid er det ingen dokumentasjon på at kombinasjonsterapi er bedre enn andre, single antibiotika ved periodontitter - der anaerobe mikroorganismer antas å være en viktig faktor. Dokumentasjonen som påberopes for bruk av KT til slike periodontitter er for varierende og er basert på studier med utilstrekkelig vitenskapelig design. Videre synes det som om denne litteraturen fullstendig har satt til side EUs og WHOs anbefalinger for bruk av mikrobiologisk diagnostikk og anvendelse av antibiotika. Ved således å innføre nødvendige tilleggskriterier for inklusjon og ekslusjon av kliniske studier må alle de inkluderte artiklene i de «SOA» av Zandbergen et al. og Sgolastra et al. (19 - 21) ekskluderes. De nevnte SOA skulle derfor aldri vært publisert.
Den forskningsbaserte anbefalingen for klinikeren er således i hovedsak basert på eldre litteratur av tilstrekkelig kvalitet (figur 2).
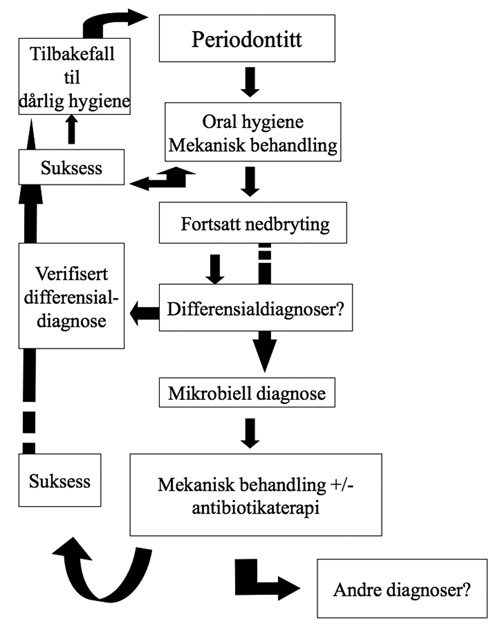
Figur 2. Beslutningsprosess for valg av behandlingsstrategi ved periodontal sykdom.
Ved periodontitt - velg vanlig fremgangsmåte:
Start med hygieneinstruksjon og motivasjon; krev god hygiene - ellers vil en systematisk behandling ha liten langvarig effekt (krav til pasienten). Vær sikker på at din SRP er av høy kvalitet; med eller uten kirurgi (krav til tannlegen). Hvis du ikke føler du er god nok til dette - henvis til spesialist i periodonti.
Skulle den periodontale destruksjon fortsette i et eller flere sites etter behandling: Sjekk først hygiene og eventuelt reinstruér/remotivér. Skulle hygienen være utilstrekkelig er gjentagelse av SRP det riktige valg av behandling - dette krever en god kommunikasjon med pasienten som forventer at man blir bra etter en behandling. Det kan dog være at du har oversett en differensialdiagnose - sjekk dette og gjennomfør behandling av disse, før eventuell rebehandling (SRP).
Hvis du ikke finner noen klar grunn for residiv/fortsettelse av destruksjonen, og er sikker på at det ikke er relatert til utilstrekkelig hygiene eller differensialdiagnostikk, kan du vurdere om antibiotika skal brukes. I så fall skal det tas en bakterieprøve, og deretter en SRP/«Full mouth desinfection» i tillegg til det antibiotikum som indikeres etter bakteriprøvesvaret (63,65). I slike tilfeller bør man henvise til kompetent spesialist i periodonti da dette er en svært vanskelig logistisk øvelse for den utrenede.
English abstract
Preus HR, Malik SA, Afzal J, Scheie AA , Bælum V.
A critical view of the practice of using amoxicillin and metronidazole in the treatment of peridontal diseases
720-32.
The «combination therapy» Metronidazole and Amoxicillin (CT) has gained a reputation as the correct and effective antibiotic regimen to use as an adjunct to scaling and root planing when treating periodontal diseases. However, there are very few - if any - good reasons for this reputation. This article summarizes the scientific documentation behind the clinician's interest for using CT as an adjunct to scaling and root planing when treating periodontal diseases. It shows that current literature of lesser in quality, mostly based on very short studies with insufficient follow-up, insufficient number of test persons, insufficient study design, general lack of microbiological diagnosis in decision making, insufficiently explained clinical procedures, and a conflicting view on the use of CT (and antibiotics in general) with WHO and EU health bodies. Aside from recurrent, aggressive periodontitis with a microbiological diagnosis of A. actinomycetemcomitans, there is no scientific support for the use of CT in the treatment of periodontal diseases. Based on existing literature adequate quality, a clinical flow diagram for decision-making and clinical treatment that involves antibiotic therapy is presented.
Hovedpunkter | |
|---|---|
· |
Dokumentasjon bak bruken av kombinasjonsterapi som tilleggsbehandling ved periodontitt er oppsiktsvekkende mager og preget av korte studier med utilstrekkelig kvalitet og vitenskapelig design. |
· |
Det er ingen studier som de siste 20 årene har dokumentert at kombinasjonsterapi er mer effektivt enn andre antibiotika ved generell periodontal sykdom, utenom de tilfellene der A. actinomycetemcomitans er involvert. |
· |
Eksisterende litteratur fra WHO og EUs anbefalinger om ikke å bruke kombinasjoner av, eller bredspektrede antibiotika uten at det er en meget god grunn for det. |
· |
Et beslutningsgrunnlag og regime for bruk av antibiotika ved periodontal sykdom fremlegges basert på eksisterende og tilstrekkelig god litteratur. |
professor. Avdeling for periodonti, Institutt for klinisk odontologi, Det odontologiske fakultet, Universitetet i Oslo.
tannlege, cand.odont. Det odontologiske fakultet, Universitetet i Oslo.
tannlege, cand.odont. Det odontologiske fakultet, Universitetet i Oslo.
professor. Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo.
professor, Institut for Odontologi, Health, Aarhus Universitet, Danmark
Artikkelen er en sterkt utvidet og popularisert versjon av et debattinnlegg («Letter to the Editor») i Journal of Periodontology 2014; 85: 374 - 84. Comments to systematic reviews on the combination of metronidazole and amoxicillin. J Periodontology' har gitt tillatelse til å trykke denne norske versjonen i NTFs Tidende.
Referanser
W. E. C. Moore, Lillian V. H Moore: The bacteria of periodontal diseases: Periodontology 2000. 1994; 5: 66 - 77
Anonymous. Consensus report on periodontal diseases: Patogenesis and microbial factors. Ann of Periodontol. 1996; 1: 926 - 32
Becker W, Becker BE, Caffesse R, et al. A longitudinal study comparing scaling, osseous surgery, and modified Widman procedures: results after 5 years. J Periodontol. 2001; 72: 1675 - 84.
Cobb CM. Clinical significance of non-surgical periodontal therapy: an evidence-based perspective of scaling and root planing. J Clin Periodontol. 2002; 29 (suppl. 2): 6 - 16.
Pawlowski AP, Chen A, Hacker BM, Mancl LA, Page RC, Roberts FA. Clinical effects of scaling and root planing on untreated teeth. J Clin Periodontol. 2005; 32: 21 - 8.
Brochut PF, Marin I, Baehni P, Mombelli A. Predictive value of clinical and microbiological parameters for the treatment outcome of scaling and root planing. J Clin Periodontol. 2005; 32: 695 - 701.
Rosalem W, Rescala B, Teles RP, Fischer RG, Gustafsson A, Figueredo CM. Effect of non-surgical treatment on chronic and aggressive periodontitis: clinical, immunologic, and microbiologic findings. J Periodontol. 2011; 82: 979 - 89.
Wayne B. Kaldahl, Kenneth L. Kalkwarf, and Kashinat D. Patil. A review of longitudinal studies that compared periodontal therapies. J Periodontal. 1993; 64: 243 - 53
Walker CB, Gordon JM, Magnusson I, Clark WB: A role for antibiotics in the treatment of refractory periodontitis. J Periodontol. 1993; 64 (suppl 8): 772 - 81.
Lang NP, Joss A, Orsanic T, Gusberti FA, Siegrist BE: Bleeding on probing, a predictor for the progression of periodontal disease? J Clin Periodontol. 1986; 13: 590 - 96.
Arie Jan Van Winkelhoff, Thomas E Rams, Jørgen Slots: Systemic antibiotic therapy in periodontitis. Periodontology 2000. 1996; 10: 45 - 78
Mombelli A. Heresy? Treatment of chronic periodontitis with systemic antibiotics only. J Clin Periodontol .2006; 33: 661 - 62.
Bittner J, Munteanu V. Potentiating action of combining metronidazole and penicillin against C. perfringens in vitro. In: Fingold, S. (ed.): Metronidazole, Proceedings of the international metronidazole conference. Montreal, Canada: Excerpta Medica Amsterdam; 1977: 293 - 98.
Van Winkelhoff AJ, Rodenburg JP, Goené RJ, Abbas F, Winkel EG, de Graaff J. metronidazole plus amoxicillin in the treatment of Actinobacillus actinomycetemcomitans associated periodontitis. J Clin Periodontol. 1989; 16: 128 - 31.
Socransky SS, Haffajee AD. Periodontal microbial ecology. Microbiology of periodontal diseases. Periodontology 2000. 2005; 38: 135 - 87.
World Health Organization. The evolving threat of antimicrobial resistance: options for action. WHO Press, World Health Organization, 2012. Geneva, Switzerland. ISBN 978 92 4 150318 1
Bronzwaer S, Lönnroth A, Haigh R. The European Community Strategy Against Antimicrobial Resistance. Euro Surveil. 2004; 9: 441. http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=441
Council recommendation of 15 November 2001 on the prudent use of antimicrobial agents in human medicine http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ: L: 2002: 034: 0013: 0016: EN: PDF
Zandbergen D, Slot DE, Cobb CM, Van der Weijden FA. The clinical effect of scaling and root planing and the concomitant administration of systemic amoxicillin and metronidazole: A systematic review. J Periodontol. 2013; 84: 332 - 51.
Sgolastra F, Patrice A, Gatto R, Monaco A. Effectiveness of systematic Amoxicillin/Metronidazole as an adjunctive therapy to full-mouth scaling and root planing in the treatment of aggressive periodontitis: a systematic review and meta-analysis. J Periodontol. 2012; 83: 735 - 43.
Sgolastra F, Gatto R, Petrucci A, Monaco A. Effectiveness of systematic Amoxicillin/Metronidazole as adjunct therapy to scaling and root planing in the treatment of chronic periodontitis: a systematic review and meta-analysis. J Periodontol. 2012; 83: 1257 - 69.
Valenza G, Veihelmann S, Peplies J, et al. Microbial changes in periodontontitis successfully treated with machanical plaque removal and systemic amoxicillin and metronidazole. Int J Med Microbiol. 2009; 299: 427 - 38.
Müller HP, Heinecke A, Borneff M, Kiencke C, Knopf A, Pohl S. Eradication of Actinobacillus actinomycetemcomitans from the oral cavity in adult periodontitis. J Periodont Res. 1998; 33: 49 - 58.
Winkel EG, van Winkelhoff AJ, van der Velden U, Additional clinical and microbiological effects of amoxicillin and metronidazole after initial periodontal therapy. J Clin Periodontol. 1998; 25: 857 - 64.
Silva MP, Feres M, Sirotto TAO, et al. Clinical and microbiological benefits of metronidazole alone or with amoxicillin as adjuncts in the treatment of chronic periodontitis: a randomized placebo-controlled clinical trial. J Clin Periodontol. 2011; 38: 828 - 37
Mestnik MJ, Feres M, Figueiredo LC, Duarte PM, Lira EAG, Faveri M. Short-term benefits of the adjuncive use of metronidazole plus amoxicillin in the microbial profile and in the clinical parameters of subjects with generalized aggressive periodontitis. J Clin Periodontol. 2010; 37: 353 - 65.
Varela VM, Heller D, Silva-Senem MX, Torres MCMB, Colombo APV, Feres-Filho EJ. Systemic antimicrobials adjunctive to a reapeated mechanical and antiseptic therapy for aggressive periodontitis: a 6-month randomized controlled trial. J Periodontol. 2011; 82: 1121 - 30.
Guerrero A, Griffiths GS, Nibali L, et al. Adjunctive benefits of systemic amoxicillin and metronidazole in non-surgical treatment of generalized aggressive periodontitis: a randomized placebo-controlled clinical trial. J Clin Periodontol. 2005; 32: 1096 - 1107.
Matarazzo F, Figueiredo LC, Cruz SEB, Faveri M, Feres M. Clinical and microbiological benefits of systemic metronidazole and amoxicillin in treatment of smokers with chronic periodontitis: a randomized placebo-controlled study. J Clin Periodontol. 2008; 35: 885 - 96.
Winkel EG, Van Winkelhoff AJ, Timmerman MF, Van der Velden U, Van der Weijden GA. Amoxicillin plus metronidazole in the treatment of adult periodontitis patients. A double-blind placebo-controlled study. J Clin Periodontol. 2001; 28: 296 - 305.
Oliveira APL, Faveri M, Gursky LC, et al. Effects of periodontal therapy on GCF cytokines in generalized aggressive periodontitis subjects. J Clin Periodontol. 2012; 39: 295 - 302.
Casarin RCV, Ribeiro EDP, Sallum EA, Nociti Jr FH, Goncalves RB, Casati MZ. The combination of amoxicillin and metronidazole improves clinical and microbiologic results of one-stage, full mouth, ultrasonic debridement in aggressive periodontitis treatment. J Periodontol. 2012; 83: 988 - 98.
Heller D, Varela VM, e Silva-Senem MX, Torres MCB, Feres-Filho EJ, Colombo APV. Impact of systemic antimicrobials combined to anti-infective mechanical debridement on the microbiota of generalized aggressive periodontitis: a 6-month RCT. J Clin Periodontol. 2011; 38: 355 - 64.
Cionca N, Giannopoulou C, Ugolotti G, Mombelli A. Microbiologic testing and outcomes of full-mouth scaling and root planing with or without amoxicillin/metronidazole in chronic periodontitis. J Periodontol. 2010; 81: 15 - 23.
Cionca N, Giannopoulou C, Ugolotti G, Mombelli A. Amoxicillin and metronidazole as an adjunct to full-mouth scaling and root planing of chronic periodontitis.. J Periodontol. 2009; 80: 364 - 71.
Del Peloso Ribeiro E, Bittancourt S, Zanin ICJ, et al. Full-mouth ultrasonic debridement associated with amoxicillin and metronidazole in the treatment of severe chronic periodontitis. J Periodontol. 2009; 80: 1254 - 64.
Johnson JD, Chen R, Lenton PA, Zhang G, Hinrichs JE, Rudney JD. Persistence of extracrevicular bacterial reservoirs after treatment of aggressive periodontitis. J Periodontol. 2008; 79: 2305 - 12.
Kaner D, Christian C, Dietrich T, Bernimoulin J-P, Kleber B-M, Friedman A. Timing affects the clinical outcome of adjunctive systemic antibiotic therapy for generalized aggressive periodontitis. J Periodontol. 2007; 78: 1201 - 08.
Guerrero A, Echeverria JJ, Tonetti MS. Incomplete adherense to an adjunctive systemic antibiotic regimen decreases clinical outcomes in generalized aggressive periodontitis patients: a pilot retrospective study. J Clin Periodontol. 2007; 34: 897 - 902.
Aimetti M, Romano F, Guzzi N, Carnevale G. Full-mouth disinfection and systemic antimicrobial therapy in generalized aggressive periodontitis: a randomized placebo-controlled trial. J Clin Periodontol. 2012; 39: 284 - 94.
Goodson JM, Haffajee AD, Socransky SS, et al. Control of periodontal infections: A randomized controlled trial I. The primary outcome attachment gain and pocket depth reduction at treated sites. J Clin Periodontol. 2012; 39: 526 - 36.
Giannopoulou C, Andersen E, Brochut P, Plagnat D, Mombelli A. Enamel matrix derivative and systematic antibiotics as adjuncts to nonsurgical periodontal treatment: Biologic response. J Periodontol 2006; 77: 707 - 13.
Mombelli A, Brochut P, Plagnat D, Casagni F, Giannopoulou C. Enamel matrix derivative and systematic antibiotics as adjuncts to nonsurgical periodontal treatment: Clinical effects. J Clin Periodontol. 2005; 32: 225 - 30.
Yek EC, Cintan S, Topcuoglu N, Kulekci G, Issever H, Kantarci A. Efficacy of amoxicillin and metronidazole combination for the management of generalized aggressive periodontitis. J Periodontol. 2010; 81: 964 - 74.
Van Winkelhoff AJ, Tijhof CJ, de Graaff J. Microbiological and clinical results of metronidazole plus amoxicillin therapy in Actinobacillus actinomycetemcomityans-associated periodontitis. J Periodontol. 1992; 63: 52 - 7.
Xajigeorgiou C, Sakellari D, Slini T, Baka A, Konstantinidis A. Clinical and microbiological effects of different antimicrobials on generalized aggressive periodontitis. J Clin Periodontol. 2006; 33: 254 - 64.
Ehmke B, Moter A, Beikler T, Milian E, Flemmig TF. Adjunctive antimicrobial therapy of periodontitis: Long-term effects on disease progression and oral colonization. J Periodontol. 2005; 76: 749 - 59.
Berglundh T, Krok L, Liljenberg B, Westfelt E, Serino G, Lindhe J. The use of metronidazole and amoxicillin in the treatment of advanced periodontal disease. A prospective, controlled clinical trial. J Clin Periodontol. 1998; 25: 354 - 62.
Flemmig TF, Milian E, Karch H, Klaiber B. Differential treatment outcome after systemic metronidazole and amoxicillin in patients harboring Actinobacillus actinomycetemcomitans and/or Porphyromonas gingivalis. J Clin Periodontol. 1998; 25: 380 - 87.
Ehmke B, Beikler T, Haubitz I, Karch H, Flemmig TF. Multifactorial assessment of predictors for prevention of periodontal disease progression. Clin Oral Invest. 2003; 7: 217 - 21.
Moeintaghavi A, Talebi-ardakani MR, Haerian-ardakani A, et al. Adjunctive effects of systemic amoxicillin and metronidazole with scaling and root planing: a randomized, placebo controlled clinical trial. J Contemp Dent Pract. 2007; 8: 51 - 9.
Baltacioglu E, Aslan M, Sarac Ö, Saybak A, Yuva P. Analysis of clinical results of systemic antimicrobials combined with nonsurgical periodontal treatment for generalized aggressive periodontitis. J Can Dent Assoc. 2011; 77: b97.
Rodrigues AS, Lourencao, Lima Neto LG, et al. Clinical and microbiologic evaluation, by real-time polymerase chain reaction, of non-surgical treatment of aggressive periodontitis associated with amoxicillin and metronidazole. J Periodontol. 2012; 83: 744 - 52.
Akincibay H, Örsal SÖ, Sengün D, Tözüm. Systemic administration of doxycycline versus metronidazole plus amoxicillin in the treatment of localized aggressive periodontitis: A clinical and microbiological study. Quintessence Int 2008; 39: 177 e33 - 9.
Machtei EE, Younis MN. The use of 2 antibiotic regimens in aggressive periodontitis: Comparison of changes in clinical parameters and gingival crevicular fluid biomarkers. Quntessence Int. 2008; 39: 811 - 9.
Moreira RM, Feres-Filho EJ. Comparison between full-mouth scaling and root planing and quadrant-wise basic therapy of aggressive periodontitis. 6-months clinical results. J Periodontol. 2007; 78: 1683 - 8.
Baderstein A, Nilveus R, Egelberg J. Effect of non-surgical periodontal therapy II. J Clin Periodontol. 1984; 11: 63 - 76.
Claffey N, Loos B, Gantes B, Martin M, Heins P, Egelberg J. The relative effects of therapy and periodontal disease on loss of probing attachment after root debridement. J Clin Perioodntol. 1988; 17: 108 - 14.
Bowers GM, Chadroff B, Carnevale R, et al. Histologic evaluation of new attachment apparatus formation in humans. PartI. J Periodontol. 1989; 60: 664 - 74.
Jorgensen MG, Slots J. Responsible use of antimicrobials in periodontics. J Calif Dent Assoc. 2000; 28: 185 - 93.
van Winkelhoff AJ, Rams TE, Slots J. Systemic antibiotic therapy in periodontics. Periodontology 2000. 1996; 10: 45 - 78.
Walker C, Karpinia K. Rationale for use of antibiotics in periodontics. J Periodontol. 2002; 73: 1188 - 96.
Preus HR, Gunleiksrud T, Sandvik L, Gjermo P, Baelum V. A randomized, double blind clinical trial comparing four periodontitis treatment strategies. One-year clinical results. J Periodontol. 2013; 84: 1075 - 86.
Veiledning i systematisk periodontittbehandling for studenter ved klinikk for allmenn voksen. http://www.odont.uio.no/iko/om/organisasjon/fagavd/periodonti/rutiner-metoder/handbok.pdf
Adresse: Hans R. Preus, Avdeling for periodonti, Institutt for klinisk odontologi, Det odontologiske fakultet, PO 1109 Blindern, 0317 Oslo.
E-post: hpreus@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Preus HR, Malik SA, Afzal J, Scheie AA , Bælum V. Et kritisk blikk på dokumentasjonen for bruk av (Amoxicillin + Metronidazol) i periodontien. Nor Tannlegeforen Tid. 2014; 124: 720-32.