Prognostiske markører i kreftsvulster fra munnhulen - quo vadis?
Plateepitelkarsinom i munnhulen er en alvorlig sykdom. Ca. 40 prosent av pasientene dør innen fem år etter at diagnosen er stilt, men på diagnosetidspunktet kan vi ikke forutsi hvilke. To prognosesystemer brukes i dag: TNM-systemet i klinikken og histologisk gradering (WHO). Verktøyene kan si noe om prognose for en gruppe pasienter, men er ikke gode nok til å forutsi prognosen for den enkelte pasient. Mange forskningsgrupper, inkludert vår egen, har prøvd å finne bedre prognostiske markører uten å lykkes. Problemet er ikke spesifikt for munnhulekreft, men gjelder de fleste krefttyper. Vi ønsker å plukke ut pasienter med en forventet dårlig prognose fordi de vil trenge en annen behandling og oppfølging enn pasienter med forventet god prognose. I denne artikkelen presenterer vi funn fra vår oversiktsartikkel i Histopathology (2013) (1). Vi har gått igjennom 172 artikler, publisert i perioden 2006 - 2012, som beskriver molekylære prognostiske studier basert på immunhistokjemi i orale plateepitelkarsinom. Konklusjonen er at det fortsatt ikke finnes noen optimale prognostiske molekylære markører for orale plateepitelkarsinomer. Dette skyldes at det generelt ikke finnes noen form for standardisering av hverken studiene eller metodene. Dermed er ikke studier og resultater reproduserbare. I tillegg er ofte pasientutvalget for lite til at man kan trekke generelle konklusjoner.
Plateepitelkarsinom, den vanligste maligne svulsten i munnhulen (figur 1), utgår fra plateepitel og er en sykdom med høy sykelighet og dødelighet. Selv om sykdommen er relativ sjelden i Norge med ca. 300 nye tilfeller årlig (munnhule og leppe), er den et mye større problem i f.eks. Sentral- og Øst-Europa og deler av Asia. Menn rammes hyppigere enn kvinner (http://www.kreftregisteret.no) (2).
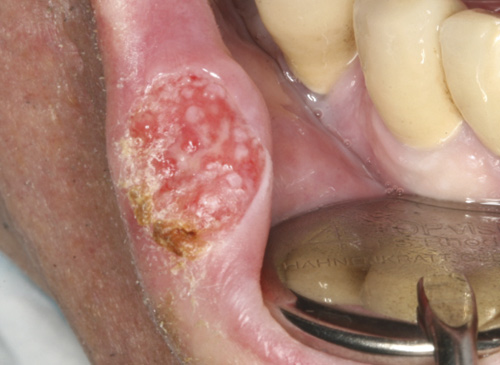
Figur 1. Klinisk bilde av et plateepitelkarsinom på innsiden av underleppen mot lepperødt Foto: Førsteamanuensis Bente B. Herlofson.
Dagens verktøy for å forutsi prognosen til pasienter med orale plateepitelkarsinomer, er TNM-systemet og WHO-gradering (3, 4). TNM (Tumour, Nodes, Metastasis) angir størrelse på tumor og om det er spredning av tumor til regionale lymfeknuter eller andre deler av kroppen. Ifølge TNM-systemet er prognosen dårligere jo større tumor er og jo mer spredning det er. Det vil si at pasienter med små svulster (T1-T2, opptil 4 cm i diameter) uten metastaser, i utgangspunktet har en god prognose, men teori og praksis stemmer ikke alltid overens. Selv små svulster i munnen kan være dødelige. Den histologiske WHO-graderingen angir tumors differensieringsgrad. Det vil si hvor mye eller lite tumorvevet ligner på normalt oralt plateepitel. Høyt differensierte svulster ligner mye på normalt plateepitel og anses å ha bedre prognose enn lavt differensierte svulster, som ligner lite på normalt plateepitel. WHO-graderingen er heller ikke optimal fordi en høyt differensiert svulst også kan være dødelig. I motsetning til WHO-graderingen, hvor hele tumorvevet undersøkes, synes invasjonsfrontgradering (IFG), hvor kun den mest invasive delen av en tumor/tumorfronten undersøkes (figur 2A), å øke den prognostiske forutsigbarheten (3, 5).
I IFG undersøkes kreftcellenes invasjonsmønster, dvs. om kreftcellene invaderer omkringliggende vev samlet i store øyer (figur 2B), i form av små øyer eller som enkeltceller (figur 2C). Pasienter med svulster som invaderer i form av store øyer anses å ha bedre prognose enn pasienter hvor kreftcellene invaderer enkeltvis eller i små øyer. IFG er utviklet av professor Magne Bryne ved Det odontologiske fakultet i Oslo (5). Selv om IFG forbedrer den prognostiske forutsigbarheten, identifiserer heller ikke denne graderingen alle pasienter med dårlig prognose. Siden ingen av de nevnte prognostiske verktøyene er optimale, har forskere gjennom mange år forsøkt å identifisere molekyler/proteiner i tumorvevet som kan gi bedre prognostisk informasjon. Til dette benyttes ofte immunhistokjemisk farging, som baserer seg på antigen-antistoffbinding i formalinfiksert vev (figur 3).
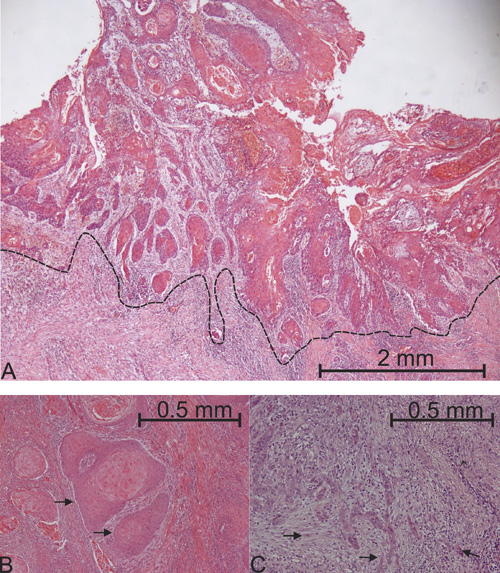
Figur 2. A-C: Invasjonsmønster i oralt plateepitelkarsinom. A: Oralt plateepitelkarsinom. Stiplet linje markerer tumorfront. B: Kollektiv tumorcelleinvasjon (svarte piler). C: Invasjon med enkeltceller/små tumorøyer (svarte piler).
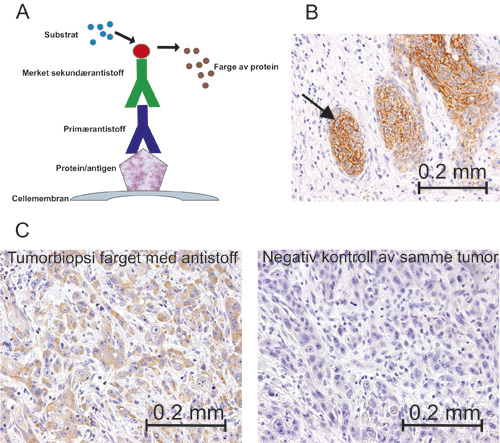
Figur 3. A-C: A: Illustrasjonsbilde av immunhistokjemisk metode. Primærantistoff binder seg til ønsket protein i cellen. Deretter tilsettes et sekundærantistoff. Substratet binder seg til komplekset bestående av primær- og sekundærantistoff og avgir farge i vevet der hvor proteinet/antigenet befinner seg. B: Resultatet av metoden i A kan ses som brun farge i vevet. C: Tumorvev farget med antistoff til venstre. Brun farge er positivt funn. Til høyre ses samme preparat, behandlet på samme måte, men primærantistoffet er fjernet. Fravær av farge viser her at antistoffet bindes spesifikt til ønsket protein og ikke uspesifikt til andre proteiner (negativ kontroll).
Kravene til en god prognostisk molekylær markør bør være at den er lett å skåre og at den må være reproduserbar. I tillegg må sensitiviteten (evne til å identifisere syke individer) og spesifisiteten (evne til å ekskludere friske individer) være høy. Hvis en markør skal ha en klinisk verdi, må den for orale plateepitelkarsinomer være bedre enn dagens TNM-inndeling og histologisk gradering.
Prognostiske studier publisert i perioden 2006 - 2012
Etter søk i PubMed-databasen fant vi 172 engelskspråklige, referee-baserte prognostiske studier av orale plateepitelkarsinomer. I disse studiene var det undersøkt til sammen 214 ulike potensielle prognostiske molekyler/proteiner. 75 prosent av proteinene var kun undersøkt i én studie. Dette var et overraskende og skuffende funn siden man trenger flere studier av det samme proteinet for å kunne undersøke om funnene lar seg reprodusere. De øvrige proteinene (25 %) var undersøkt i flere studier, men likevel var det veldig få studier av hvert enkelt protein. De tre hyppigst studerte proteinene var proliferasjonsmarkøren Ki67, tumor- supressor-molekylet p53 og epidermal vekstfaktor-reseptor (EGFR).
Faktorer som påvirker vurderingen av en mulig prognostisk markør
Publikasjonsskjevhet
Publikasjonsskjevheten er et stort problem for vurderingen av nye prognostiske markører. Nesten alle studiene viste et protein med en statistisk signifikant prognostisk verdi, dvs. at det var en sammenheng mellom uttrykk av et protein og pasientens prognose. Denne overveldende mengden av studier med signifikante prognostiske resultater er et generelt og bekymringsfullt problem innen kreftforskningen og representerer trolig en publikasjonsskjevhet (6). Fraværet av studier uten prognostisk verdi kan indikere en underrapportering av funn som ikke er signifikante. Dessverre er det slik at tidsskrifter generelt ønsker å publisere nye og signifikante funn, og dette kan fordreie virkelighetsbildet. Studier av markører uten statistisk signifikans, hvis de blir publisert, kommer gjerne fram som et bifunn i en artikkel om et annet prognostisk signifikant molekyl. Det finnes riktignok et par tidsskrifter som publiserer negative resultater («The All Results Journals» og «The Journal of Negative Results in BioMedicine»), men disse er ikke godt kjent, og ingen artikler fra disse tidsskriftene dukket opp i våre søk. Manglende kunnskap om eksisterende negative funn øker risikoen for at studier repeteres unødvendig og at det sløses med penger, tid og verdifullt pasientmateriale.
Tidsskriftenes krav og forskernes ønske om å publisere nye mulig prognostiske markører bidrar til at listen over molekyler som blir undersøkt i orale plateepitelkarsinomer stadig blir lengre. Ut fra et klinisk synspunkt ville det ha vært mye mer hensiktsmessig om tidligere studier ble repetert på et nytt pasientmateriale av andre forskningsgrupper. Først ved en slik fremgangsmåte kan man vurdere brukbarheten av en mulig ny markør.
Studiepopulasjon: størrelse og utvalg
Antallet orale plateepitelkarsinomer inkludert i de ulike studiene varierte fra 20 til 319. De fleste studiene inkluderte under 100 plateepitelkarsinomer. Det lave antallet av svulster kan sette begrensninger for den statistiske analysen og tolkningen av disse. For all biologisk forskning gjelder at statistisk signifikante funn ikke nødvendigvis har biologisk betydning. Ulike statistiske metoder krever at ulike forutsetninger er oppfylt for at de skal kunne gi pålitelige resultater, en spesialkunnskap som kan kreve bruk av statistiker. Dessverre ser det ut til at noen studier bruker statistiske metoder som krever større studiepopulasjoner enn det som er tilgjengelig i den aktuelle studien. Andre bruker uriktige metoder. For å forbinde molekyluttrykk med prognosedata, brukes i noen studier kun enkle sammenligninger istedenfor mer avansert overlevelsesanalyse som tar hensyn til tiden fra diagnosetidspunkt til pasienten enten får residiv eller dør av svulsten. På grunn av ukorrekt bruk av statistikk kan et statistisk signifikant funn være direkte galt. Derfor må man i prognostiske studier se med et kritisk blikk på valg av statistisk metode og tolkning.
For å vurdere en markørs prognostiske betydning, må man sørge for at andre forhold som kan påvirke prognosen minimeres. Ved studier av orale plateepitelkarsinomer er det best at svulstene er så like som mulig, for eksempel innen samme TNM-stadium. Dessverre fant vi at studiepopulasjonene ofte besto av en blanding av svulster med ulik TNM-inndeling og histologisk gradering. Vi mener at fremtidige studier fortrinnsvis bør gjøres på homogene grupper av svulster, og helst på små plateepitelkarsinomer, siden de ofte fjernes i sin helhet. For eksempel vil klinisk vurdering og behandling påvirke prognosen i mindre grad i små svulster enn i store svulster med spredning. Generelt har små svulster bedre prognose enn større og mer avanserte svulster. Siden prognosen til avanserte svulster lar seg påvirke i større grad av ytre faktorer, er det vanskeligere å identifisere en molekylær markør hvor innflytelsen på prognosen ikke overskygges av de andre ytre faktorene. Svulster har forskjellige størrelser, og for å sikre at det er markøren og ikke størrelsen på svulsten som gir prognostisk verdi, bør svulster som sammenlignes være i samme undergruppe (T-stadium).
Immunhistokjemi som metode
Vev som skal brukes til immunhistokjemisk farging, må fikseres og støpes inn i parafin. Flere av trinnene i denne prosessen kan påvirke fargeresultatet. For eksempel kan en biopsi som har ligget lenge i fikseringsvæske, gi svakere farge enn en som har ligget kort tid i fikseringsvæsken. Derfor er vi skeptiske til resultater som baserer seg på fargeintensitet. Immunhistokjemi er ikke en standardisert metode, og mange faktorer kan påvirke fargeresultatet. Dermed er det viktig at både positive og negative kontroller inkluderes i forsøkene. Dessverre fant vi i vår undersøkelse at mange studier manglet positiv og/eller negativ kontroll. Dette gjør at vi ikke kan være sikre på at konklusjonene er riktige, og studiene blir verdiløse. Likevel, selv med slike store mangler i metodebruken, blir studiene publisert og benyttet som både premiss og sammenligningsgrunnlag i andre studier. I figur 3C vises et tumorvev som er immunfarget (til venstre) og en negativ kontroll av det samme preparatet (til høyre). Hvis den negative kontrollen hadde vist brunfarge ville dette tydet på en uspesifikk binding av antistoffet i tumorvevet. Dermed ville man ikke med sikkerhet vite hvilket molekyl man studerte. «The Human Protein Atlas»-portalen har gjort en stor innsats for å kvalitetssikre farging med antistoff i forskjellige vev med optimal bruk av kontroller (http://www.proteinatlas.org), men listen av antistoffer i portalen er langt fra komplett.
Skåring av tumorvev
I de fleste studiene er det ikke beskrevet hvor i svulsten undersøkelsen/skåringen av molekyluttrykket er gjort. Bare noen få studier beskriver dette nærmere. De fleste svulster er heterogene, dvs. at kreftcellenes differensieringsgrad og egenskaper varierer gjennom svulsten. Dette kan påvirke uttrykk av molekylære markører. I noen områder av en svulst kan kreftcellene uttrykke markøren, mens den ikke uttrykkes i andre områder. Hvilken del av tumoren er det da riktig å undersøke? På grunn av det varierende uttrykket er det viktig at man gir en klar beskrivelse av hvordan skåringen gjøres, og hvilken del av svulstvevet som undersøkes (figur 4). Av samme grunn bør man vurdere å inkludere snitt fra flere og dypere lag av svulsten i analysen. Dette vil øke arbeidsbyrden, men vil trolig gi et riktigere bilde av molekyluttrykket i hver enkelt svulst enn om bare ett snitt er vurdert.
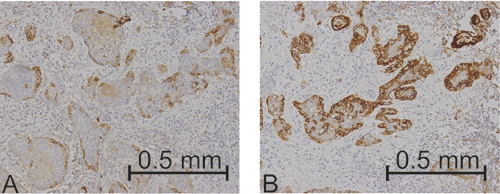
Figur 4, A-B: Illustrasjon over hvor ulikt en molekylær markør kan uttrykkes på forskjellige steder i en tumor. Brunfarge i cellene betyr at markøren er til stede. A: Få kreftceller uttrykker markøren. B: De fleste kreftcellene uttrykker markøren.
De hyppigst studerte molekylære markørene
Blant de molekylære markørene som er studert i perioden oktober 2006 til oktober 2012, er 25 % inkludert i mer enn én studie. De tre hyppigst studerte proteinene var proliferasjonsmarkøren Ki67 med 11 studier (7 - 17), tumor-suppressor-molekylet p53 med 11 studier (8, 10, 15, 16, 18 - 24) og epidermal vekstfaktor-reseptor (EGFR) med 7 studier (9, 16, 18, 19, 25 - 27). En oppsummering av studiene av Ki67, p53 og EGFR viste en tydelig mangel på standardisering. I disse studiene varierte antallet pasienter/svulster fra 28 til 198, de fleste studiene inkluderte under 100. Svært få studier spesifiserte hvor i vevet skåringen av markøren var utført. I tillegg manglet de fleste studiene optimale kontroller. Resultatene fra overlevelsesanalysene, i de studiene hvor analysen var inkludert, var svært sprikende. For eksempel kunne en markør forutsi god prognose i noen studier og dårlig prognose i andre studier. Konklusjonen blir at verken Ki67, p53 eller EGFR kan brukes som en prognostisk markør for orale plateepitelkarsinom pr. i dag.
Konklusjon
Intensiv jakt på molekylære prognostiske markører gjennom flere tiår har ikke gitt oss en klinisk brukbar molekylær prognostisk markør som er bedre enn de eksisterende prognostiske verktøyene. Dette problemet gjelder de fleste krefttyper. Denne gjennomgangen av prognostiske undersøkelser viste at studiene var heterogene med tanke på studiedesign, metoder og statistiske analyser. Nesten alle studiene kunne vise til en statistisk signifikant markør, men den kliniske verdien av denne markøren er sjelden bekreftet i andre studier. De få studiene som er repetert, er umulige å sammenligne på grunn av heterogenitet i studiedesign og manglende informasjon om utførelsen. Vi er bekymret for kvaliteten på prognostiske studier i orale plateepitelkarsinomer, og at det sløses med tid, penger og verdifullt pasientmateriale. Det er helt nødvendig med standardisering av prognostiske studier. Det finnes et system for standardisering, REMARK (Reporting Recommendations for Tumor Marker Prognostic Studies) (28), men dette er nesten ikke i bruk, både fordi forskere ikke kjenner til systemet og at systemet er tidkrevende og mer arbeids- og kostnadskrevende hvis det skal følges.
Til tross for vår kritiske holdning til prognosestudiene vi har gjennomgått, må vi få tilføye at ny viten likevel er generert. Selv om en ny og bedre prognostisk markør ikke er identifisert, kan studiene lære oss en del om proteinuttrykk i celler. De kan fortelle både hvor og i hvilke celler ulike proteiner er uttrykt, noe som gradvis gir oss bedre forståelse av patobiologien i munnhulekreft.
Quo vadis? Hvis vi skal ha håp om å finne en klinisk relevant markør, må fremtidige studier først og fremst kvalitetskontrolleres og standardiseres. For at vi skal kunne lykkes i denne jakten, kreves det at forskere innser problemene med dagens studier og er villige til å ta den jobben det er å lage gode og store nok prognostiske studier.
Takk
Forfatterne vil takke professor Hilde K. Galtung for konstruktive kommentarer under bearbeidelsen av manuskriptet. Takk til førsteamanuensis Bente B. Herlofson ved Avdeling for oral kirurgi og oral medisin ved Det odontologiske fakultet i Oslo, for klinisk bilde.
English summary
Søland TM, Brusevold IJ.
Prognostic molecular markers in cancer - quo vadis?
364-68.
Intensive search during several decades has failed to identify new prognostic molecular markers in oral cancer. This review-article is based on our present article in Histopathology (2013) (1) where we evaluated 172 immunohistochemical prognostic marker studies in oral squamous cell carcinomas (OSCC) from 2006 to 2012. In general, the studies are heterogeneous in study design, the use of assay methods and statistical analyses. Almost all studies demonstrate a significant prognostic marker, but this marker is rarely confirmed in other studies. p53 (11 studies), Ki67 (11 studies) and EGFR (7 studies) were the most frequently studied markers in OSCC. The diverging results from these studies on small cohorts indicate that none of them can be recommended for routine clinical use as prognostic markers in OSCC.
Quo vadis? Further studies should ensure that all the steps from collection of biopsies until final scoring of the staining are performed in as standardized a manner as possible. Only then will we be able to properly evaluate prognostic molecular markers based on immunohistochemistry in tissue sections. This will cost time and resources, but in the long term we believe that the effort will lead to the identification of new prognostic markers.
Hovedbudskap | |
|---|---|
· |
Det finnes ingen optimale prognostiske markører for orale plateepitelkarsinomer. |
· |
En god prognostisk markør bør være lett å skåre, være reproduserbar, ha høy sensitivitet og spesifisitet. Ingen slike finnes i dag. |
· |
Dagens studier av mulige prognostiske markører har ikke høy nok kvalitet. |
· |
For at studier basert på immunhistokjemisk metode skal kunne identifisere prognostiske markører i orale plateepitelkarsinomer må det i fremtiden kreves:- Optimalisering og standardisering av studiemetoden- Sammenlignbare studier- Samarbeid mellom forskningsgrupper, også internasjonalt, for å få store nok studiepopulasjoner. |
førsteamanuensis. Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo
postdoktor. Institutt for oral biologi, Det odontologiske fakultet og Avdeling for farmakologi, Det medisinske fakultet, begge ved Universitetet i Oslo
Referanser
Søland TM, Brusevold IJ. Prognostic molecular markers in cancer - quo vadis? Histopathology. 2013; 63(3): 297 - 308.
Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011; 61(2): 69 - 90.
Barnes LE, JW. Reichart, P. Sidranski,D. World health organization classification of tumours. Pathology and genetics of head and neck tumours. Lyon: IARCPress; 2005.
Harmer M. TNM classification of malignant tumours. 3rd ed. Geneva: International union against cancer; 1987.
Bryne M, Boysen M, Alfsen CG, Abeler VM, Sudbø J, Nesland JM, et al. The invasive front of carcinomas. The most important area for tumour prognosis? Anticancer Res. 1998; 18(6B): 4757 - 64.
Kyzas PA, Denaxa-Kyza D, Ioannidis JP. Almost all articles on cancer prognostic markers report statistically significant results. Eur J Cancer. 2007; 43(17): 2559 - 79.
Bitu CC, Destro MF, Carrera M, da Silva SD, Graner E, Kowalski LP, et al. HOXA1 is overexpressed in oral squamous cell carcinomas and its expression is correlated with poor prognosis. BMC Cancer. 2012; 12: 146.
Coutinho-Camillo CM, Lourenco SV, Nishimoto IN, Kowalski LP, Soares FA. Nucleophosmin, p53, and Ki-67 expression patterns on an oral squamous cell carcinoma tissue microarray. Hum Pathol. 2010; 41(8): 1079 - 86.
Diniz-Freitas M, Garcia-Caballero T, Antunez-Lopez J, Gandara-Rey JM, Garcia-Garcia A. Pharmacodiagnostic evaluation of EGFR expression in oral squamous cell carcinoma. Oral Dis. 2007; 13(3): 285 - 90.
Fourati A, El May MV, Ben Abdallah M, Gamoudi A, Mokni N, Goucha A, et al. Prognostic evaluation of p53, heat shock protein 70, Ki67, and CD34 expression in cancer of the tongue in Tunisia. J Otolaryngol Head Neck Surg. 2009; 38(2): 191 - 6.
Freudlsperger C, Rohleder SE, Reinert S, Hoffmann J. Predictive value of high Ki-67 expression in stage I oral squamous cell carcinoma specimens after primary surgery. Head Neck. 2011; 33(5): 668 - 72.
Gonzalez-Moles MA, Ruiz-Avila I, Gil-Montoya JA, Esteban F, Bravo M. Analysis of Ki-67 expression in oral squamous cell carcinoma: why Ki-67 is not a prognostic indicator. Oral Oncol. 2010; 46(7): 525 - 30.
Klimowicz AC, Bose P, Nakoneshny SC, Dean M, Huang L, Chandarana S, et al. Basal Ki67 expression measured by digital image analysis is optimal for prognostication in oral squamous cell carcinoma. Eur J Cancer. 2012; 48(14): 2166 - 74.
Lee JI, Jin BH, Kim MA, Yoon HJ, Hong SP, Hong SD. Prognostic significance of CXCR-4 expression in oral squamous cell carcinoma. Oral Surg Oral Med Oral Path Oral Radiol Endod. 2009; 107(5): 678 - 84.
Motta Rda R, Zettler CG, Cambruzzi E, Jotz GP, Berni RB. Ki-67 and p53 correlation prognostic value in squamous cell carcinomas of the oral cavity and tongue. Braz J Otorhinolaryngol. 2009; 75(4): 544 - 9.
Shah NG, Trivedi TI, Tankshali RA, Goswami JV, Jetly DH, Shukla SN, et al. Prognostic significance of molecular markers in oral squamous cell carcinoma: a multivariate analysis. Head Neck. 2009; 31(12): 1544 - 56.
Tamura T, Shomori K, Haruki T, Nosaka K, Hamamoto Y, Shiomi T, et al. Minichromosome maintenance-7 and geminin are reliable prognostic markers in patients with oral squamous cell carcinoma: immunohistochemical study. J Oral Pathol Med. 2010; 39(4): 328 - 34.
Won HS, Jung CK, Chun SH, Kang JH, Kim YS, Sun DI, et al. Difference in expression of EGFR, pAkt, and PTEN between oropharyngeal and oral cavity squamous cell carcinoma. Oral Oncol. 2012; 48(10): 985 - 90.
Trivedi TI, Tankshali RA, Goswami JV, Shukla SN, Shah PM, Shah NG. Identification of site-specific prognostic biomarkers in patients with oral squamous cell carcinoma. Neoplasma. 2011; 58(3): 217 - 26.
Oliveira LR, Ribeiro-Silva A, Zucoloto S. Prognostic significance of p53 and p63 immunolocalisation in primary and matched lymph node metastasis in oral squamous cell carcinoma. Acta Histochem. 2007; 109(5): 388 - 96.
de Oliveira LR, Ribeiro-Silva A, Zucoloto S. Prognostic impact of p53 and p63 immunoexpression in oral squamous cell carcinoma. J Oral Pathol Med. 2007; 36(4): 191 - 7.
Oliveira LR, Ribeiro-Silva A, Costa JP, Simoes AL, Matteo MA, Zucoloto S. Prognostic factors and survival analysis in a sample of oral squamous cell carcinoma patients. Oral Surg Oral Med Oral Path Oral Radiol Endod. 2008; 106(5): 685 - 95.
Vlatkovic N, El-Fert A, Devling T, Ray-Sinha A, Gore DM, Rubbi CP, et al. Loss of MTBP expression is associated with reduced survival in a biomarker-defined subset of patients with squamous cell carcinoma of the head and neck. Cancer. 2011; 117(13): 2939 - 50.
Chen SF, Yu FS, Chang YC, Fu E, Nieh S, Lin YS. Role of human papillomavirus infection in carcinogenesis of oral squamous cell carcinoma with evidences of prognostic association. J Oral Pathol Med. 2012; 41(1): 9 - 15.
Szabo B, Nelhubel GA, Karpati A, Kenessey I, Jori B, Szekely C, et al. Clinical significance of genetic alterations and expression of epidermal growth factor receptor (EGFR) in head and neck squamous cell carcinomas. Oral Oncol. 2011; 47(6): 487 - 96.
Agra IM, Carvalho AL, Pinto CA, Martins EP, Filho JG, Soares FA, et al. Biological markers and prognosis in recurrent oral cancer after salvage surgery. Arch Otolaryngol Head Neck Surg. 2008; 134(7): 743 - 9.
Nakata Y, Uzawa N, Takahashi K, Sumino J, Michikawa C, Sato H, et al. EGFR gene copy number alteration is a better prognostic indicator than protein overexpression in oral tongue squamous cell carcinomas. Eur J Cancer. 2011; 47(15): 2364 - 72.
McShane LM, Altman DG, Sauerbrei W, Taube SE, Gion M, Clark GM. REporting recommendations for tumor MARKer prognostic studies (REMARK). Nat Clin Pract Oncol. 2005; 2(8): 416 - 22.
Adresse: Tine M. Søland, Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo. E-post: t.m.soland@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Søland TM, Brusevold IJ. Prognostiske markører i kreftsvulster fra munnhulen - quo vadis? Nor Tannlegeforen Tid. 2014; 124: 364-68.