Livskvalitet, munntørrhet og kliniske funn hos pasienter med Sjögrens syndrom
Munntørrhet er et utbredt symptom hos pasienter med primært Sjögrens syndrom (pSS) og har sammenheng med redusert helserelatert livskvalitet. Målet med denne studien var å vurdere omfanget og samsvaret av orale kliniske funn hos pSS pasienter med rapporterte subjektive plager.
Pasienter ble rekruttert fra en studie som fokuserte på oral og helserelatert livskvalitet hos pSS pasienter. Fra denne studien ble 22 pasienter som rapporterte et høyt antall subjektive plager inkludert i en klinisk studie som omfattet en detaljert klinisk undersøkelse. I tillegg ble spørreskjemaer relatert til oral og generell livskvalitet fra den første studien utfylt på nytt.
Munntørrhet ble rapportert hos 91 % av pasientene. Patologisk lave verdier av ustimulert og stimulert helsaliva, samt saliva fra parotiskjertelen ble påvist hos henholdsvis 16, 13 og 8 pasienter. Gjennomsnittlig DMFT var 20,7, og høy candida-forekomst ble funnet hos 15 pasienter. Andre kliniske funn som karies, periodontitt og periimplantitt varierte blant pasientene. Lav salivasekresjon korrelerte med enkelte parametere for helserelatert livskvalitet.
Pasientenes subjektive orale plager samsvarte ofte med kliniske orale funn som lav salivasekresjon, høy DMFT og oral candidose. Omfanget av, og variasjonene i, kliniske manifestasjoner belyser behovet for individuell veiledning og behandling av pSS pasienter.
Primært Sjögrens Syndrom (pSS) er en autoimmun sykdom som først og fremst rammer spytt- og tårekjertler, noe som resulterer i uttalt munn- og øyetørrhet (1). I forskning som handler om pSS er klassifikasjonskriteriene fra American European Consensus Group (AECG) mest benyttet. De består av seks kriterier, hvor to dekker subjektive tegn på tørrhet i munn og øyne, og fire omfatter objektive mål på nedsatt sekresjon av spytt og tårer, autoantistoff (Anti-Ro (SSA) og Anti-La (SSB)) og histopatologisk evaluering av spyttkjertler fra underleppe. For at en pasient skal oppfylle AECG-kriteriene, må enten minst 3 av 4 objektive kriterier være oppfylt, eller minst 4 av alle 6 kriterier, og for sistnevnte kreves enten positiv spyttkjertelbiopsi (fokusskår 1) eller positiv serologi (2). Basert på AECG-kriteriene, er prevalensen av pSS i Norge estimert til å være 0,05 %, og pasientene er hovedsakelig postmenopausale kvinner (3). Videre er pSS forbundet med ekstraglandulære symptomer som leddsmerte, utmattelse, lungeaffeksjon og økt risiko for utvikling av non-Hodgkins lymfom (4 - 7).
Lav spyttsekresjon hos pSS pasienter settes i sammenheng med økt kariesrisiko (8), oral candidose (9) og slimhinneforandringer (10). Videre er det vist at orale sykdommer påvirker både sosiale og psykologiske aspekter (11), og at subjektive, orale symptomer i pSS har en markert innvirkning på helserelatert livskvalitet (10, 12 - 14). Samsvaret mellom pasientens subjektive plager og objektive orale funn er mindre undersøkt.
I denne studien defineres orale plager som tilstedeværelsen av mange orale symptomer kombinert med en høy sammenlagt skår i The Oral Health Impact Profile-14 (OHIP-14) som ofte anvendes som et mål på oral livskvalitet (15). Hovedformålet med studien var å beskrive orale, kliniske manifestasjoner blant pSS pasienter og se på samsvaret mellom disse og pasientenes subjektive orale plager. Studien fokuserer på pasienter som rapporterer mange orale plager og vår hypotese er at disse pasientene også vil ha kliniske manifestasjoner som reflekterer dette.
Metode
Pasienter
I 2010 ble det gjennomført en tverrsnittsstudie som omhandlet orale plager og helserelatert livskvalitet hos pSS-pasienter. Studien var et samarbeid mellom Oslo Universitetssykehus Rikshospitalet og Universitetet i Oslo (UiO) og resultatene ble publisert i 2011 (12). Studien inkluderte 163 pSS-pasienter registrert enten i Norsk systemisk bindevevssykdom- og vaskulitt-register (NOSVAR) eller ved Avdeling for oral medisin og oral kirurgi, Det odontologiske fakultet, UiO. Av de 163 pasientene, ble 22 pasienter som rapporterte et gjennomsnittlig høyt nivå av orale plager invitert til en klinisk studie.
Klinisk undersøkelse
Pasientene fikk instruksjoner om ikke å spise, drikke eller røyke minst en time før den kliniske undersøkelsen, og alle pasientene fikk time før kl. 1200. Undersøkelsen startet med ekstraoral inspeksjon, etterfulgt av registrering av objektive tegn på munntørrhet, salivatester, sopptester og klinisk inspeksjon av munnhulen, og undersøkelsen ble avsluttet med utfylling av spørreskjemaer (se under).
Pasientene ble undersøkt ekstraoralt for å evaluere forstørrede spyttkjertler, tørre lepper og tørr hud. Intraoral undersøkelse var basert på Clinical Score of Oral Dryness (CSOD) utviklet av Osalian et al. (16). Denne omfatter 10 kliniske tegn på munntørrhet, der hvert klinisk tegn gir 1 poeng, maksimum skår er 10, og verdi mellom 1 og 10 indikerer den objektive alvorlighetsgraden av munntørrhet. Munnslimhinnen ble også inspisert for orale forandringer og tegn på sykdom. Candidaprøver ble tatt fra kinn, tunge og munngulv, og på grunnlag av antall kolonier på Saboraud-medium etter 4 dager ble funnene gruppert på følgende måte: ingen vekst (0 kolonier), moderat vekst (1 - 9 kolonier), markert vekst (10 - 29 kolonier) og uttalt vekst (> 30 kolonier).
Ustimulert helsaliva ble samlet i 15 minutter og salivasekresjon ble målt i ml/min (1g=1ml) og regnet som patologisk dersom den var £ 0,1 ml/min (17). For stimulert helsaliva, ble pasientene bedt om å tygge på en parafintablett (Orion diagnostica, Asker, Norge) i 5 minutter, og sekresjonen regnet som patologisk dersom den var £ 0,7 ml/min (18). Stimulert parotis-saliva ble samlet ved hjelp av en modifisert Curby-cup fra høyre glandula parotis som beskrevet (19), og sekresjonen regnet som patologisk dersom den var £ 0,4 ml/min (20).
Det ble tatt et panoramarøntgen av hver pasient og alle tenner utenom visdomstenner ble undersøkt klinisk. Benpatologi generelt samt periodontalt bentap/bentap rundt implantater og DMFT ble vurdert på bakgrunn av klinisk og radiologisk undersøkelse.
Spørreskjemaer
Short-Form 36 Health Survey Versjon 1.0 er et generisk spørreskjema som kartlegger helserelatert livskvalitet. Det består av 36 spørsmål inndelt i 8 underkategorier: fysisk funksjonsevne (PF), rollebegrensninger av fysiske årsaker (RP), rollebegrensninger av emosjonelle årsaker (RE), vitalitet (Vit), kroppslige smerter (BP), sosial funksjonsevne (SF), mental helse (MH) og generell oppfatning av egen helse (GH). Svarene danner en skår fra 0 til 100, der 0 indikerer dårligst mulig helse og 100 indikerer best mulig helse (21). Reliabiliteten, validiteten og sensitiviteten i den norske versjonen av SF-36 har vist seg å være tilfredsstillende, og normalmateriale for den norske populasjonen har blitt fremskaffet av Loge og medarbeidere (22, 23).
OHIP-14 omfatter ulike aspekter av oral helse gjennom 14 spørsmål som dekker 7 dimensjoner: funksjonell begrensning, fysisk smerte, psykologisk ubehag, fysisk funksjonshemming, psykisk funksjonshemming, sosial funksjonshemming og handicap (15, 24). Summen av svarene danner en sammenlagt skår fra 0 - 56, hvor en høy skår indikerer dårlig oral helse (25). Normalmateriale for den norske befolkningen foreligger, og reliabiliteten og validiteten for den norske OHIP-14 versjonen er funnet tilfredsstillende (26).
I tillegg besvarte pasientene et spørreskjema som omhandlet symptomer spesielt relatert til pSS. Spørreskjemaet inneholdt 21 spørsmål om orale symptomer, mens tørre øyne, utmattelse og smerte ble kartlagt gjennom 6 spørsmål hver.
De tre spørreskjemaene ble utfylt to ganger av pasientene; først i mailundersøkelsen og senere i forbindelse med den kliniske studien.
Etisk godkjenning
Studien er godkjent av Regionale komiteer for medisinsk og helsefaglig forskningsetikk, region sør-øst (2010/1292) og skriftlig samtykke ble innhentet fra hver pasient.
Statistisk analyse
Statistisk analyse ble utført ved å bruke SPSS versjon 18 (IBM SPSS Statistics, Armonk, NY, USA). Data for livskvalitet og subjektive symptomer var tilnærmet normalfordelte. Normalmaterialet for SF-36 ble justert for alder og kjønn (23). Ett-utvalgs t-test ble brukt ved sammenligning av resultatene fra pSS-pasientene med normalmateriale for OHIP-14 og SF-36. Ved sammenligning av pasientgrupper over tid ble t-test benyttet. Sammenheng mellom kliniske målinger og resultater fra OHIP-14 og SF-36 ble analysert ved hjelp av Spearmans rank korrelasjonskoeffisient. Statistisk signifikans ble satt til p £ 0,05.
Resultater
Pasienter
Av de 163 pasientene i mailundersøkelsen ble totalt 22 pasienter inkludert i denne kliniske oppfølgingsstudien. Demografiske og sosiale karakteristika, komorbiditet, sykdomsvarighet og medisinbruk er vist i tabell 1.
Demografiske og sosiale karakteristika |
n=22 |
|
|---|---|---|
Alder (år) (gjennomsnitt SD, range) |
58 15, 18 - 77 |
|
Rase (kaukasisk: andre) (n) |
21: 1 |
|
Høyde (cm SD) |
165 5 |
|
Vekt (kg SD) |
68 5 |
|
Utdanning / Yrke (n, %) |
Utdannelse utover videregående skole |
17 (77,3) |
Sykemeldt / uføretrygdet |
5 (22,7) |
|
I arbeid fulltid / deltid |
8 (36,4) |
|
Pensjonert |
9 (40,9) |
|
Gift / Samboer (n, %) |
10 (45,5) |
|
Har barn (n, %) |
16 (72,2) |
|
Røyker (n, %) |
Nåværende røyker |
2 (9,1) |
Nåværende ikke-røyker |
20 (90,9) |
|
Tidligere røyker |
6 (27,3) |
|
Sykdomsvarighet og komorbiditet og (n, %) |
||
Sykdomsvarighet (år SD) |
11,3 8 |
|
Nåværende: |
Tidligere: |
|
Kreft |
1 (4,5) |
0 (100) |
Kardiovaskulær sykdom |
5 (22,7) |
0 (100) |
Diabetes |
1 (4,5) |
1 (4,5) |
Hypotyreose |
2 (9,1) |
0 (100) |
Nåværende medikamenter |
(n, %) |
|
Antidepressiva |
1 (4,5) |
|
Allergimedisiner |
3 (13,6) |
|
Antihypertensiva |
6 (23,7) |
|
Antipsykotika |
1 (4,5) |
|
Betablokkere |
1 (4,5) |
|
Antikoagulantia |
5 (22,7) |
|
Antidiabetika |
2 (9,1) |
|
Diuretika |
1 (4,5) |
|
Kolesterolsekende medisiner |
5 (22,7) |
|
Tyroidea hormoner |
3 (13,6) |
|
Analgetika |
5 (22,7) |
|
Østrogener |
1 (4,5) |
|
Kortikosteroider |
2 (9,1) |
|
Proton-pumpe inhibitorer |
1 (4,5) |
|
Plaquenil |
13 (59,1) |
|
Andre medikamenter |
3 (13,6) |
I gjennomsnitt var tiden fra mailundersøkelsen til deltakelsen i den kliniske undersøkelse 10 måneder (range 6 - 21 måneder). Med hensyn til SF-36 dannet de 22 pasientene samlet sett et representativt utvalg for populasjonen i mailundersøkelsen. Da man ønsket å undersøke en gruppe med høy grad av orale plager, var OHIP-14 sammenlagt skår som forventet noe høyere blant deltagerne i den kliniske undersøkelsen (n=22) enn blant pasientene i mailundersøkelsen (n=163, 18,811,3 vs. 17,712,4).
Kliniske data
Objektive funn relatert til munntørrhet: Gjennomsnittlig CSOD-skår blant de 22 pasientene var 3,3 (1,7). Ingen av pasientene hadde forstørrede spyttkjertler ved undersøkelsestidspunktet. De vanligste ekstraorale hudforandringene var tørre lepper (27 %), angulær cheilitt (18 %) og tørr hud (14 %). Blant intraorale forandringer og tegn på sykdom var tungeforandringer (36 %), tynn slimhinne (32 %) og fibromer/polypper (18 %) hyppigst observert. Høye antall candidakolonier var et vanlig funn, og ble observert hos 15 av de 22 pasientene (moderat vekst ble funnet hos 4 pasienter, markert vekst hos 3 pasienter og uttalt vekst hos 8 pasienter).
Spyttsekresjon: For ustimulert helsaliva var gjennomsnittlig sekresjon 0,10 (0,1) ml/min, 16 pasienter hadde patologisk lav sekresjon (£0,10 ml/min), hvorav 6 pasienter hadde ingen målbar sekresjon. Gjennomsnittlig stimulert helsaliva var 0,75 (0,7) ml/min; 13 av pasientene hadde sekresjonsrate under patologisk verdi (0,7 ml/min), hvorav 4 pasienter hadde ingen sekresjon. For stimulert parotissaliva var gjennomsnittlig sekresjon på 0,5 (0,5) ml/min, 8 pasienter hadde patologisk lav sekresjon (£0,4 ml/min), og 3 av disse pasientene hadde ingen sekresjon.
Dentale og skeletale funn: Pasientene hadde en gjennomsnittlig DMFT på 20,7 (6). En pasient hadde kun dentale implantater, en hadde partiell protese og en hadde helproteser i begge kjever. Nitten pasienter hadde molarer, og av disse hadde 2 pasienter molarer med økt vertikal og horisontal mobilitet, og 3 hadde molarer med furkasjonsinvolvment. Videre hadde 11 pasienter flere periodontale områder med blødning ved sondering og 4 hadde periodontale lommer 5mm. Ingen av pasientene hadde benpatologi som uttalte apikale oppklaringer eller cyster.
Livskvalitet og orale symptomer
Svarene fra SF-36 og OHIP-14 ved mailundersøkelsen og i forbindelse med den kliniske undersøkelsen hos de 22 pasientene var ikke signifikant forskjellige. Sammenlignet med aldersjustert norsk normalmateriale for kvinner hadde de 22 pSS-pasientene signifikant lavere skår på følgende SF-36 underkategorier: BP, GH, Vit og SF (Tabell 2).
PF |
RP |
BP |
GH |
Vit |
SF |
RE |
MH |
|
|---|---|---|---|---|---|---|---|---|
Normalmateriale |
71,0 |
57,2 |
65,7 |
68,2 |
54,9 |
80,0 |
71,6 |
77,5 |
pSS |
68,6 |
39,7 |
53,0* |
39,9* |
39,5* |
68,1* |
55,6 |
72,9 |
* signifikant forskjell mellom de 22 pSS-pasientene i den kliniske studien og normalmateriale
Kolonnene representerer de 8 SF-36 underkategoriene: fysisk funksjonsevne (PF), rollebegrensninger av fysiske årsaker (RP), rollebegrensninger av emosjonelle årsaker (RE), vitalitet (Vit), kroppslige smerter (BP), sosial funksjonsevne (SF), mental helse (MH) og generell oppfatning av egen helse (GH).
Frekvensen av orale symptomer som ble rapportert i den kliniske undersøkelsen er vist i Tabell 3. Rapporterte orale symptomer ved de to undersøkelsene var stabil. De tre vanligste symptomene var munntørrhet i mer enn 3 måneder, nødvendigheten av å drikke mye vann på grunn av munntørrhet og vansker med å svelge mat på grunn av munntørrhet (alle tre symptomer ble rapportert av 20 pasienter, 91 %). Videre var fordelingen av symptomer relatert til tørre øyne, kroniske smerter og utmattelse også lik ved de to undersøkelsene.
Orale symptomer |
n ( %) |
|---|---|
Daglig følelse av munntørrhet i mer enn 3 måneder? |
20 (90,9) |
Tilbakevendende eller persisterende hovne spyttkjertler som voksen? |
11 (50) |
Ubehag, smerte eller ømhet i munn? |
10 (45,5) |
Opplever dårlig ånde? |
13 (59,1) |
Opplever redusert smakssans? |
9 (40,9) |
Opplever tilbakevendende soppinfeksjon? |
8 (36,4) |
Opplever heshet? |
15 (68,2) |
Føler at maten stanser opp under svelging? |
18 (81,8) |
Drikker mye vann pga munntørrheten? |
20 (90,9) |
Bruker tyggegummi eller pastiller for å øke spyttsekresjon? |
13 (59,1) |
Bruker olje/ gel til å fukte munnslimhinnen med? |
6 (27,3) |
Nødvendig med hyppig væskeinntak for å kunne svelge tørr mat? |
20 (90,9) |
Våkner opp om natten pga munntørrheten? |
15 (68,2) |
Spiser sakte pga munntørrheten? |
8 (36,4) |
Vanskeligheter med å snakke pga munntørrheten? |
14 (63,6) |
Har tannimplantater? |
1 (4,6) |
Har hel- eller delproteser? |
2 (9,1) |
Med hensyn til ekstraorale symptomer, rapporterte 19 (86 %) pasienter daglig øyetørrhet i mer enn 3 måneder og 11 (50 %) brukte øyedråper mer enn 3 ganger daglig. Videre beskrev 18 (82 %) utmattelse, og 11 pasienter (50 %) sa at de opplevde utmattelse i så stor grad at daglige gjøremål ble påvirket. Totalt 14 (64 %) pasienter rapporterte kroniske leddsmerter og 13 (59 %) oppga muskelsmerter. Pasientene ble også bedt om å rangere alvorlighetsgraden av de ulike symptomene. Det mest plagsomme symptomet for de fleste pasientene var munntørrhet, (rapportert av 13), mens henholdsvis utmattelse (4 pasienter), smerter (3 pasienter) og øyetørrhet (2 pasienter) var det mest plagsomme symptom for de øvrige.
Korrelasjoner mellom orale funn, livskvalitet og orale symptomer
Korrelasjoner mellom subjektive orale plager, OHIP-14, SF-36 og kliniske funn hos de 22 pasientene ble undersøkt. Vi fant en positiv og signifikant korrelasjon mellom OHIP-14 sammenlagt skår og antall orale symptomer (r=0,6). Lav helsalivasekresjon, både ustimulert og stimulert, korrelerte med økt kroppslig smerte (r=-0,5 for begge). Videre viste SF-36 kategoriene Vit og SF negative korrelasjoner med antall utmattelsessymptomer (r=-0,6 for begge). CSOD-skår viste ingen signifikante korrelasjoner med øvrige parametere.
Til tross for at de fleste pasientene rapporterer mange subjektive plager, var det store individuelle variasjoner i omfanget av kliniske funn, noe som er vist i figur 1 og 2.
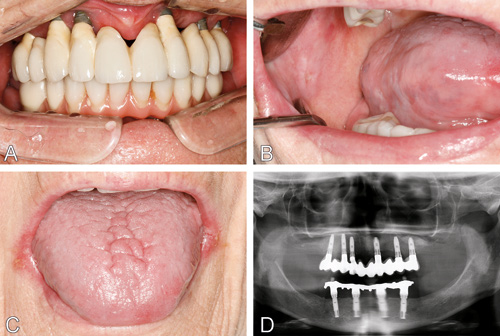
Figur 1. 83 år gammel kvinne, diagnostisert med pSS for 35 år siden. Kasuset illustrerer en situasjon der selvrapporterte orale symptomer reflekteres av orale kliniske funn (kliniske bilder A, B, C og OPG D). Pasienten hadde nedsatt generell livskvalitet (lav SF-36 skår) og nedsatt oral livskvalitet (svært høy OHIP-14 sammenlagt skår (31) og 18 av 21 bekreftede orale symptomer). Objektiv evaluering av munntørrhet ved hjelp av CSOD skår viste maksium verdi (10). Dette manifesterte seg klinisk ved mangel på salivapool i munngulvet, alvorlig fissuert/lobulert tunge og uttalt oral candidose med angulær cheilitt. Pasienten hadde 10 implantater med protetiske toppkonstruksjoner (DMFT 28) og peri-implantitt. Pasienten hadde ingen målbar salivasekresjon.
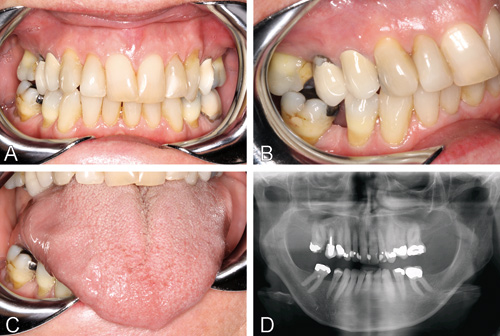
Figur 2. 67 år gammel pasient, diagnostisert med pSS for 9 år siden. Kasuset demonstrerer en pasient med mange symptomer på munntørrhet, men med færre åpenbare kliniske manifestasjoner (kliniske bilder A, B, C og OPG D). Hennes generelle livskvalitet var god (høy SF-36 skår), mens den orale livskvaliteteten var nedsatt (middels høy OHIP-14 skår (10) og 15 av 21 bekreftede orale symptomer). Kliniske funn: CSOD skår 3, DMFT 21, ustimulert helsaliva 0,1 ml/min, stimulert helsaliva 2,4 ml/min og parotissaliva 1,4 ml/min. Hun hadde ingen tydelige orale forandringer eller infeksjoner.
Diskusjon
Denne kliniske studien beskriver orale manifestasjoner i en undergruppe av 163 pSS-pasienter som tidligere har deltatt i en mailundersøkelse angående helserelatert livskvalitet og orale plager (12). Basert på den større studien, ble 22 pasienter som i gjennomsnitt rapporterte mange orale plager undersøkt klinisk. De objektive, orale funnene avdekket lav salivasekresjon, høy DMFT og høy forekomst av candida.
Selv om de fleste pasientene hadde lav salivasekresjon og redusert oral helse, varierte de objektive manifestasjonene av munntørrhet fra grav karies, uttalt oral candidose og peri-implantitt hos noen, til få objektive funn hos andre. Foruten signifikant korrelasjon mellom salivasekresjon og enkelte SF-36 underkategorier, ble det påvist få klare sammenhenger mellom kliniske funn og selvrapportert helserelatert livskvalitet og orale plager. Høy OHIP-14 sammenlagt skår korrelerte med høyt antall tørrhetssymptomer. De to figurene illustrerer at hos noen pasienter var det sterk sammenheng mellom rapporterte orale plager og orale kliniske funn, mens hos andre som ga uttrykk for mange orale plager, var det færre objektive funn (figur 1 og 2).
Undersøkelse av objektive funn relatert til munntørrhet ved hjelp av CSOD-skår viste lavere skår enn tidligere rapportert hos pasienter med pSS (3,31,7 vs. 7,50,7) (16). Denne skåren ble utviklet for å studere progresjon av munntørrhet over tid, og for å kunne evaluere responsen på terapeutiske intervensjoner. Vår erfaring var at CSOD-skåren er best egnet til bruk for pasienter med uttalte objektive manifestasjoner, som illustrert i figur 1.
Som forventet, hadde pasientene i den kliniske studien lav salivasekresjon, i likhet med funn i andre studier (14, 27). At så mange av pasientene hadde lav spyttsekresjon, medfører imidlertid at man ikke finner signifikante korrelasjoner mellom spyttsekresjon og andre variabler. I en større studie, rapporterte Stewart et al signifikant negativ korrelasjon (r=-0,49) mellom ustimulert helsaliva og OHIP-14 sammenlagt skår (14). Videre hadde våre pasienter høyere DMFT sammenlignet med pSS-pasienter i lignende studier (8, 9, 28). Dette skyldes nok også at vi valgte ut pasienter med mange orale plager. Derimot hadde våre pasienter lav forekomst av periodontal sykdom, som observert av Ravald et al (29), men i kontrast til den positive sammenhengen mellom pSS og periodontale forhold rapportert av Antoniazzi et al (30). Høy candida-forekomst observert i vår studie er i samsvar med tidligere funn (9). De mest vanlige intraorale forandringer var tungeforandringer (funnet hos 36 %) og tynn munnslimhinne (observert hos 31 %). Det må tas høyde for at dette er en relativt liten studie som fokuserer på pasienter med mange orale plager, og at funnene våre ikke nødvendigvis er representative for pSS pasienter generelt. Andre faktorer som kronisk leddsmerte og utmattelse kan også forklare den redusert helserelaterte livskvalitet som ses hos pSS-pasienter (4, 31).
Mellom de to tidspunktene pasientene ble undersøkt fant vi ingen signifikante endringer i resultatene fra OHIP-14 og SF-36, eller i frekvensen av orale symptomer. Dette kan indikere at progresjonen av pSS er langsom, slik det er rapportert i andre studier (32), eller at utvalget var for lite til å avdekke en forskjell.
Den diagnostiske gullstandarden for pSS, er den kliniske bedømmelsen foretatt av en erfaren revmatolog, og de gjeldende klassifikasjonskriteriene for pSS inkluderer subjektive symptomer relatert til tørrhet i munn og øyne (2). Til tross for lav spesifisitet, kan vurdering av orale plager bidra til å bedre karakteriseringen av pSS-pasienter, fange opp viktige aspekter ved sykdommen relatert til pasient-velvære og identifisere pSS-pasienter tidlig i sykdomsprogresjonen (34). Vår hypotese, at hos pasienter med mange orale plager, vil man også observere oralpatologiske funn, bekreftes i denne studien. Pasientrapporterte symptomer kan være nyttige for tannleger og annet helsepersonell i utredning og behandling av pSS. Individuelt tilpasset informasjon om behandling og konsekvenser av munntørrhet kan være vesentlig for å opprettholde optimal oral helse og helserelatert livskvalitet. Gjennom målrettede intervjuer og kliniske undersøkelser kan tannleger og annet helsepersonell tilrettelegge individuelle regimer bestående av tiltak for å stimulere salivasjonen, fluortilskudd, kostholdsendringer, samt forskriving av salivasubstitutter og andre nødvendige medisiner. Regelmessig tannbehandling er et viktig ledd i å opprettholde god livskvalitet hos munntørre pasienter generelt og hos pasienter med pSS spesielt.
Konklusjoner
Vi har tidligere vist at pSS-pasienter både har redusert livskvalitet generelt og relatert til munnhulen. En undergruppe av pasientene som rapporterte mange plager fra munnhulen ble undersøkt klinisk, og det ble funnet nedsatt spyttsekresjon, soppinfeksjoner, høy DMFT, tynn slimhinne og tungeforandringer. Til tross for at pasientene rapporterte mange orale plager, var det stor variasjon i de kliniske funnene. Pasienter med pSS har derfor behov for individuelt tilrettelagt behandling og tiltak der tannlegen spiller en viktig rolle.
Takk
Forfatterne vil takke professor Leiv Sandvik for hjelp med de statistiske analysene. Videre takker vi ansatte ved Avdeling for oral kirurgi og oral medisin for all hjelp underveis. Til slutt retter vi en stor takk til pasientene med Sjögrens syndrom som sa seg villige til å være med i undersøkelsen.
English summary
Grigoriou M, Enger TB, Øveraasen HC, Palm Ø, Garen T, Jensen JL.
Quality of life, oral dryness and clinical findings in patients with Sjögren's Syndrome
820-6.
Oral dryness is a main complaint in patients with primary Sjögren's Syndrome (pSS) and is associated with decreased health related quality of life. This study aims to evaluate the extent of oral clinical findings in patients with subjective complaints, hypothesizing that oral findings are prevalent in patients with many subjective complaints.
Twenty-two patients who reported many subjective oral complaints in a previous mail survey were included in the clinical study. A detailed clinical examination was performed and questionnaires related to quality of life and dryness symptoms were again completed.
Dry mouth was reported by 91 % of the patients. Impaired production of unstimulated whole saliva, stimulated whole saliva, and parotid saliva was observed in 16, 13 and 8 patients, respectively. Mean DMFT was 20.7, and high candida counts were found in 15 patients. Other clinical findings varied among patients including caries, periodontitis, oral candidiasis, and peri-implantitis. Low saliva secretion correlated with some parameters for health-related quality of life.
Our findings demonstrate that subjective measures were reflected by oral clinical findings of low salivary secretion, high DMFT and candidiasis. The wide spectrum of symptoms and clinical findings among pSS patients stress the need for individual treatment.
Hovedbudskap | |
|---|---|
· |
Subjektive orale plager hos denne pasientgruppen er utbredt og må møtes med forståelse hos tannlegen. |
· |
Hos pSS pasienter som rapporterer uttalte orale plager, gjøres ofte objektive orale funn, men omfanget av kliniske manifestasjoner er varierende. - Individuelle tiltak må iverksettes ut fra den enkelte pasients behov. |
Referanser
Delaleu N, Jonsson R, Koller MM. Sjogren's syndrome. Eur J Oral Sci. 2005; 113: 101 - 13.
Vitali, C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, et al. Classification criteria for Sjogren's syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis 2002; 61; 554 - 558.
Goransson LG, Haldorsen K, Brun JG, Harboe E, Jonsson MV, Skarstein K, et al. The point prevalence of clinically relevant primary Sjogren's syndrome in two Norwegian counties. Scand J Rheumatol. 2011; 40: 221 - 4.
Haldorsen K, Bjelland I, Bolstad AI, Jonsson R, Brun JG. A five-year prospective study of fatigue in primary Sjogren's syndrome. Arthritis Res Ther. 2011; 13: R167. doi: 10.1186/ar3487.
Johnsen SJ, Brun JG, Goransson LG, Smastuen MC, Johannesen TB, Haldorsen K, et al. Risk of non-Hodgkin's lymphoma in primary Sjogren's syndrome: a population-based study. Arthritis Care Res. 2013; 65: 816 - 21.
Palm O, Garen T, Enger TB, Jensen JL, Lund MB, Aalokken TM, et al. Clinical pulmonary involvement in primary Sjogren's syndrome: prevalence, quality of life and mortality - a retrospective study based on registry data. Rheumatology. 2013; 52: 173 - 9.
Theander E, Henriksson G, Ljungberg O, Mandl T, Manthorpe R, Jacobsson LT. Lymphoma and other malignancies in primary Sjogren's syndrome: a cohort study on cancer incidence and lymphoma predictors. Ann Rheum Dis. 2006; 65: 796 - 803.
Christensen LB, Petersen PE, Thorn JJ, Schiodt M. Dental caries and dental health behavior of patients with primary Sjogren syndrome. Acta Odontol Scand. 2001; 59: 116 - 20.
Lundstrom IM, Lindstrom FD. Subjective and clinical oral symptoms in patients with primary Sjogren's syndrome. Clin Exp Rheumatol. 1995; 13: 725 - 31.
Fox PC, Bowman SJ, Segal B, Vivino FB, Murukutla N, Choueiri K, et al. Oral involvement in primary Sjogren syndrome. J Am Dent Assoc. 2008; 139: 1592 - 601.
Reisine ST. The impact of dental conditions on social functioning and the quality of life. Annu Rev Public Health. 1988; 9: 1 - 19.
Enger TB, Palm O, Garen T, Sandvik L, Jensen JL. Oral distress in primary Sjogren's syndrome: implications for health-related quality of life. Eur J Oral Sci. 2011; 119: 474 - 80.
Lopez-Jornet P, Camacho-Alonso F. Quality of life in patients with Sjogren's syndrome and sicca complex. J Oral Rehabil. 2008; 35: 875 - 81.
Stewart CM, Berg KM, Cha SG, Reeves WH. Salivary dysfunction and quality of life in Sjogren syndrome - A critical oral-systemic connection. J Am Dent Assoc. 2008; 139: 291 - 9.
Slade GD, Spencer AJ. Development and evaluation of the Oral Health Impact Profile. Community Dent Health. 1994; 11: 3 - 11.
Osailan SM, Pramanik R, Shirlaw P, Proctor GB, Challacombe SJ. Clinical assessment of oral dryness: development of a scoring system related to salivary flow and mucosal wetness. Oral Surg Oral Med Oral Pathol Oral Radiol. 2012; 114: 597 - 603.
Sreebny LM, Valdini A. Xerostomia. Part I: Relationship to other oral symptoms and salivary gland hypofunction. Oral Surg Oral Med Oral Pathol. 1988; 66: 451 - 8.
Malmstrom MJ, Segerberg-Konttinen M, Tuominen TS, Hietanen JH, Wolf JE, Sane JI, et al. Xerostomia due to Sjogren's syndrome. Diagnostic criteria, treatment and outlines for a continuous dental care programme and an open trial with Sulfarlem. Scand J Rheumatol. 1988; 17: 77 - 86.
Sproles A, Schaeffer LD. An advanced design of the Carlson-Crittenden cup for collection of parotid fluid. Biomater Med Devices Artif Organs. 1974; 2: 95 - 101.
Fox PC, Busch KA, Baum BJ. Subjective reports of xerostomia and objective measures of salivary gland performance. J Am Dent Assoc. 1987; 115: 581 - 4.
Ware JE, Jr. SF-36 health survey update. Spine. 2000; 25: 3130 - 9.
Loge JH, Kaasa S. Short form 36 (SF-36) health survey: normative data from the general Norwegian population. Scand J Soc Med. 1998; 26: 250 - 8.
Loge JH, Kaasa S, Hjermstad MJ, Kvien TK. Translation and performance of the Norwegian SF-36 Health Survey in patients with rheumatoid arthritis. I. Data quality, scaling assumptions, reliability, and construct validity. J Clin Epidemiol. 1998; 51: 1069 - 76.
Locker D. Measuring oral health: a conceptual framework. Community Dent Health. 1988; 5: 3 - 18.
Slade GD. Derivation and validation of a short-form oral health impact profile. Community Dent Oral Epidemiol. 1997; 25: 284 - 90.
Holst D, Dahl KE. Oral health related quality of life. A national, descriptive survey. Nor Tannlegeforen Tid. 2008; 118: 212 - 8.
Pedersen AM, Reibel J, Nauntofte B. Primary Sjogren's syndrome (pSS): subjective symptoms and salivary findings. J Oral Pathol Med. 1999; 28: 303 - 11.
Leung KC, McMillan AS, Leung WK, Wong MC, Lau CS, Mok TM. Oral health condition and saliva flow in southern Chinese with Sjogren's syndrome. Int Dent J. 2004; 54: 159 - 65.
Ravald N, List T. Caries and periodontal conditions in patients with primary Sjogren's syndrome. Swed Dent J. 1998; 22: 97 - 103.
Antoniazzi RP, Miranda LA, Zanatta FB, Islabao AG, Gustafsson A, Chiapinotto GA, et al. Periodontal conditions of individuals with Sjogren's syndrome. J Periodontol. 2009; 80: 429 - 35.
Mengshoel AM, Norheim KB, Omdal R. Primary Sjogren's syndrome - Fatigue is an ever-present, fluctuating and uncontrollable lack of energy. Arthritis Care Res. 2013. 2014; 66: 1227-32. doi: 10.1186/ar3487.
Gannot G, Lancaster HE, Fox PC. Clinical course of primary Sjogren's syndrome: salivary, oral, and serologic aspects. J Rheumatol. 2000; 27: 1905 - 9.
tannlege. Det odontologiske fakultet, Universitetet i Oslo
tannlege, dobbeltkompetansekandidat. Det odontologiske fakultet, Universitetet i Oslo
tannlege. Det odontologiske fakultet, Universitetet i Oslo
overlege. Avdeling for revmatologi, Rikshospitalet , Oslo universitetssykehus
rådgiver. Avdeling for revmatologi, Rikshospitalet, Oslo universitetssykehus
professor. Avdeling for oral kirurgi og oral medisin, Det odontologiske fakultet, Universitetet i Oslo
Artikkelen er delvis basert på en omarbeidet utgave av mastergradsarbeidet til Melina Grigoriou og Helle Charlotte Øveraasen
Adresse: Janicke Liaaen Jensen, Avdeling for oral kirurgi og oral medisin, Det odontologiske fakultet, postboks 1109 Blindern, 0317 Oslo. E-post: j.c.l.jensen@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.
Grigoriou M, Enger TB, Øveraasen HC, Palm Ø, Garen T, Jensen JL. Livskvalitet, munntørrhet og kliniske funn hos pasienter med Sjögrens syndrom. Nor Tannlegeforen Tid. 2014; 124: 820-6.