Prioner og endodonti – engangs- eller flergangsbruk av rotkanalinstrumenter?
Forfattere
spesialistkandidat. Institutt for klinisk odontologi – endodonti, Universitetet i Bergen
førsteamanuensis. Institutt for klinisk odontologi – endodonti, Universitetet i Bergen
professor. Institutt for klinisk odontologi – endodonti, Universitetet i Bergen
Rotkanalinstrumenter, på linje med mange andre dentale instrumenter, har en overflatestruktur som gjør renhold og sterilisering problematisk. Spørsmål om engangs- eller flergangsbruk av rotkanalinstrumenter er blitt aktualisert gjennom økt kunnskap om prionproteiner, som i en unormal variant ikke brytes ned, men akkumuleres i hjernen og forårsaker sykdom, såkalt transmissible spongiform encephalopathy (TSE). Hos mennesker forekommer bl.a. Creutzfeldt-Jacobs sykdom (CJD). Prioner er til dels resistente mot degradering og vil vanskelig inaktiveres ved vanlige steriliseringsprosedyrer. Det er frem til i dag ikke påvist smitte av CJD gjennom tannbehandling, men det er en teoretisk mulighet for smitteoverføring. For pasienter med kjent sykdomsrisiko skal alle brukte instrumenter destrueres ved brenning, og alle flater hvor det er mistanke om søl av organisk materiale skal kjemisk desinfiseres. Metoder for rengjøring er gjerne mangelfulle når det gjelder fjerning av biologisk materiale på instrumenter. I noen land, blant annet Storbritannia, har en tatt konsekvensen av dette og innført påbud om bruk av engangsutstyr, herunder endodontiske rotkanalinstrumenter, ved all invasiv tannbehandling, Ettersom rengjøringsprosedyrer for endodontiske instrumenter er vanskelige og tidkrevende, anbefales engangsbruk av slike instrumenter. Dette mer for å lette hverdagen i tannlegepraksis i Norge, enn grunnet faren for overføring av prionsykdom.
Apikal periodontitt er et resultat av infeksjon i rotkanalsystemet. Målet med endodontisk behandling er å forebygge eller eliminere infeksjon og hindre reinfeksjon av rotkanalen. Dette gjøres primært ved hjelp av kjemo-mekanisk rengjøring. Ulike varianter av endodontiske instrumenter er tilgjengelig, men selv om de forskjellige typer instrumenter arbeider ulikt i rotkanalen har alle til hensikt å forme kanalen og fjerne innhold i den.
Kanalinstrumenter (filer og reamere) er relativt små og med en kompleks overflatestruktur som gjør renhold og sterilisering problematisk (Figur 1). Ettersom disse instrumentene ofte rengjøres og brukes flere ganger, er det ønskelig med en diskusjon om rengjørings- og steriliseringsprosedyrer for rotkanalinstrumenter og mulig smitterisiko (kryssinfeksjon) mellom pasienter. Dette er særlig aktualisert med tanke på prionproteiner som forårsaker Creutzfeldt-Jacobs sykdom (CJD).
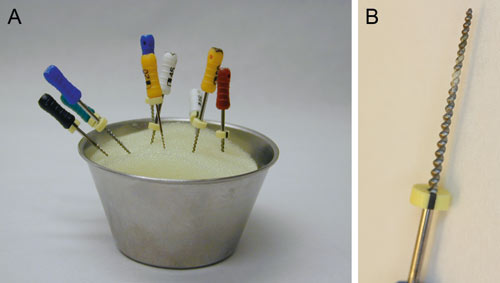
Figur 1. A: Rotkanalinstrumenter i oppsats under bruk. B: Nærbilde av brukt rotkanalinstrument som viser organisk materiale i skjæredelen av instrumentet.
En grundig beskrivelse av prioner og prionsykdom er tidligere publisert i Den norske tannlegeforenings Tidende i 2001 (1). Denne oversikten er en oppfølging av nevnte artikkel, med vekt på endodontisk behandling.
Rengjøring, desinfeksjon og sterilisering
Rengjøring av instrumenter er viktig og nødvendig for å oppnå sterile instrumenter uten rester av biologisk materiale. Rengjøring innebærer fjerning av organisk materiale og mikroorganismer før sterilisering (2). Skrubbing, skylling og ultralyd er metoder som ofte benyttes til dette formål. Metoder for å teste renhet på et instrument er imidlertid lite utviklet.
Desinfeksjon beskriver en prosess som eliminerer mange eller alle patogene mikroorganismer, med unntak av bakterielle sporer, på livløse objekter. Dette oppnås vanligvis med flytende kjemikalier eller våt pasteurisering (2). Graden av desinfeksjon er påvirket av flere faktorer, som alle kan redusere effekten. Noen av disse faktorene er rengjøring av objektet, mengden av organisk eller uorganisk materiale, type og nivå av mikrobiell kontaminering, eksponeringstid, temperatur og pH (2).
Sterilisering innebærer fullstendig eliminering eller destruksjon av alle typer mikrobielt liv ved hjelp av fysiske eller kjemiske prosesser (2). Damp under trykk, tørr varme, etylenoksidgass, hydrogenperoksidgassplasma og flytende kjemikalier er virkemidler som gjerne brukes for sterilisering. Når kjemikalier brukes for å ødelegge alle former for mikrobiologisk liv, inklusiv sopp og bakteriesporer, kalles de kjemiske steriliseringsmetoder (2).
I tabell 1 gis en oversikt over metoder for desinfeksjon og sterilisering. Instrumenter som er brukt ved invasiv behandling av pasienter med mistenkt eller bekreftet CJD skal kasseres som smitteavfall og destrueres ved brenning (3).
Metode |
Middel/Produkt |
||
|---|---|---|---|
Desinfeksjon |
Kjemisk |
Klorpreparater |
Diversol® (4 %)Sanogene® (klordioksid 2 %) |
Glutaraldehyd |
Cidex-preparater |
||
Desinfesjonssprit |
Etanol- 70 % |
||
Fenolpreparater |
Orotol®/Orotol Ultra® |
||
Varme |
Vaskemaskin |
Vann, 85C |
|
Koking |
Vann, 100C |
||
Sterilisering |
Kjemisk |
Ethylenoksidgass |
|
Hydrogenperoksidgass |
|||
Flytende kjemikalier |
2N natriumhydroksid i en time |
||
Varme |
Autoklavering |
Vanndamp, 121 – 134C* |
|
Tørrsterilisering** |
160 – 180C |
||
For mer utfyllende informasjon om desinfeksjon og sterilisering henvises det til Den norske tannlegeforenings kvalitetshåndbok fra 2004 (4).
Prioner
Prionproteinet (PrP) er et membranbundet glykoprotein, som normalt finnes hos mennesker og dyr. Proteinet finnes i mange celler, men med størst konsentrasjon i nervevev. Den cellulære funksjonen til prioner er til dels ukjent (5). Det normalt forekommende prionproteinet (PrPC) kan endre konfigurasjon til den patogene formen PrPSc (Figur 2). I motsetning til PrPC nedbrytes ikke PrPSc, men kan akkumuleres i hjernen og forårsake irreversibel skade. Akkumuleringen av dette konformasjonsendrete proteinet (PrPSc) i sentralnervesystemet gir opphav til sykdom av typen transmissible spongiform encephalopathy (TSE). Det forekommer flere TSEs hos mennesker, den viktigste kalles Creutzfeldt-Jacobs sykdom (CJD). Hos dyr forekommer flere forskjellige TSE-sykdommer, bl.a. skrapesyke (scrapie) hos sau, som ansees som den typiske prionsykdommen. Den viktigste formen av TSE er bovine spongiform encephalopathy (BSE) som er en zoonose, og som kan gi variant CJD (vCJD) hos menneske. TSE gir degenerering av hjernens grå substans med fatale neurodegenerative lidelser som følge (5).
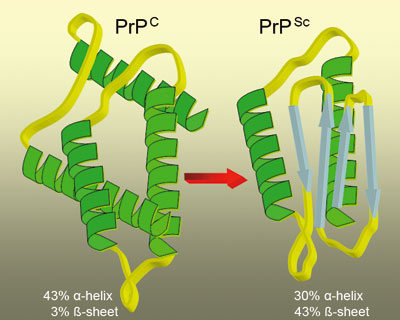
Figur 2. Illustrasjonen viser to ulike konfigurasjoner av den samme prionstrukturen. Konfigurasjonen til venstre viser normalt prion (PrPC), mens den til høyre er infeksiøs og patogen (PrPSc). Stor andel av «-sheet» gjør proteiner mer stabile mot degradering og mer sykdomsassosiert (26). Faktorer som fremmer omdannelsen av den tredimensjonale strukturen er ukjent.
Sykdomsbildet ble første gang beskrevet i 1920. Senere er flere ulike typer av CJD beskrevet (Tabell 2). Hovedgruppene er sporadisk CJD (sCJD), familiær CJD (fCJD) (påvist på 1960-tallet) og ervervet CJS (eCJD). sCJD regnes som en overførbar, men ikke smittsom sykdom, og ble eksperimentelt overført til sjimpanser første gang i 1968. Det er dokumentert overføring av sCJD gjennom forurensede nevrokirurgiske instrumenter. Undergrupper av eCJD er Kuru, iatrogen CJD (iCJD) (påvist i 1974), og variant CJS (vCJD) (påvist i 1996). Kuru er relatert til kannibalisme på Papua New Guinea og anses i dag som utdøende (grunnet lang latensperiode forventes likevel nye tilfeller). iCJD forårsakes av veksthormonpreparater (hypofysederivater) og transplantasjoner (cornea og dura mater) fra pasienter med sporadisk CJD. vCJD anses som den humane formen av kugalskap (BSE).
Inndeling |
Spredning |
Andel av CJD* |
Forløp |
|
|---|---|---|---|---|
Sporadisk CJD (sCJD) |
Uten identifiserbar årsak |
85 % |
Middelaldrende og eldre Rask progresjon |
|
Familiær CJD (fCJD) |
Autosomal dominant(20 mulige mutasjoner) |
10 – 15 % |
Unge og middelaldrende Noe lengre forløp |
|
Ervervet CJD |
Kuru |
Papua New Guinea (kannibalisme) |
Utdøende |
|
Variant CJD (vCJD) |
Første rapportert i 1996 (Storbritannia) etter inntak av BSE-kontaminert mateiale |
203 i 2007, hvorav 164 i Storbritannia |
Ungdom og unge voksne Raskt forløp |
|
Iatrogen CJD (iCJD) |
Neurokirurgi Hornhinnetransplantasjon Injeksjon av hypofyse- hormoner Kryssinfeksjon med dentale instrumenter? |
Ca. 400 tilfeller totalt på verdensbasis |
||
Det har vært betydelig oppmerksomhet omkring disse sykdommene etter at den nye variant av sykdommen, vCJD, dukket opp i Storbritannia i 1996. vCJD er antatt forårsaket av inntak av BSE-kontaminert mat (blandede kjøttprodukter som hamburgere og pølser). Frem til august 2005 hadde en registrert 180 tilfeller på verdensbasis, hvorav 166 er døde og 14 fremdeles i live. Totalt 175 av disse tilfellene var registrert i Europa, hvorav 157 i England (5, 6). I juni 2007 var det på verdensbasis rapportert 203 tilfeller av bekreftet eller mistenkt vCJD (6). De fleste tilfeller utenfor Storbritannia antas å ha blitt eksponert for BSE-agens under opphold i Storbritannia (7).
sCJD har en bemerkelsesverdig lik forekomst over hele verden, dvs. 0,5 – 2 tilfeller per million innbyggere per år. De første tilfellene av sCJD ble påvist i Norge på 1930-tallet. fCJD er også påvist i Norge. Fra 2001 til 2007 er det meldt 32 dødsfall til Meldingssystem for smittsomme sykdommer (MSIS) ved Folkehelseinstituttet i Norge (6). Av disse dødsfall skyldes de fleste sCJD, med noen få tilfeller av fCJD. Det er ikke oppdaget noen tilfeller av vCJD i Norge.
Inkubasjonstiden kan variere fra 4 til 40 år. Det forandrede proteinet vandrer fra Peyer-plettene i tarmen til follikulære dentritiske celler i lymfeknuter og milt, der det repliseres. Senere når proteinene ryggmargen og hjernen der videre replikasjon skjer og perifer spredning starter (8).
Sykdomsutviklingen for alle typer av CJD er dramatisk, med en rask utvikling av demens. Pasienten dør som oftest 1 – 2 år etter klinisk påvist sykdomsutbrudd. Det finnes til dags dato ingen tilgjengelig behandling. Over 90 % av pasientene med sporadisk CJD dør innen et år etter at symptomene debuterte.
Det finnes i dag ingen enkel test som kan diagnostisere ulike former for CJD. Endelig bekreftelse av diagnose og type av prionsykdom er avhengig av neuropatologisk og immunhistokjemisk undersøkelse av hjernevev (biopsi eller prøve tatt post mortem).
Smitte
Det finnes i dag ikke bevis for at CJD smitter fra person til person ved normal sosial kontakt, aerosoler eller seksuell kontakt. Det er heller ikke påvist smitte av sCJD gjennom blodoverføring, men det foreligger mulig blodtransfusjonssmitte av vCJD dersom donor er i preklinisk fase ved donasjon (9). Av denne grunn utelukkes personer med mistenkt TSE, samt deres søsken, barn, foreldre og samboere fra blodgiving i Norge på permanent basis. Det samme gjelder personer som har fått vev eller vevsprodukter som kan overføre sCJD eller vCJD (transplantasjon dura mater, hornhinne eller veksthormon). Personer som har oppholdt seg i Storbritannia i mer enn ett år tilsammen i perioden 1980 til 1996 utelukkes også fra blodgiving. Det samme gjelder personer som har mottatt blodtransfusjon i Storbritannia etter 1980 (6).
Det er kun teoretisk mulighet for TSE-smitte av helsepersonell ved uhell som nålestikk. Fram til i dag er det ikke påvist smitte av vCJD via dentale prosedyrer (10). Det finnes likevel to teoretiske måter for smitte via dentale instrumenter: 1) instrumenter som berører linguale tonsiller som er infeksiøse i vCJD tilfeller (ansees for å være ekstremt lav – 104 –109 ganger mindre enn ved tonsillektomi), og 2) kontakt med dentalt pulpavev, hvor det er teoretisk mulig at pulpavev på pasienter med subklinisk vCJD kan være infisert (også eCJD, sCJD og fCJD) (11, 12).
Ved mistanke om TSE, skal invasive prosedyrer og blodprøvetaking reduseres til et minimum. Dersom det er risiko for blodsøl bør en bruke engangsutstyr. Engangsutstyr og forbruksmateriell som er kontaminert med blod eller kroppsvæsker skal i spesialemballasje og brennes. Invasivt flergangsutstyr (for eksempel kirurgiske instrumenter) destrueres. Ikke-invasivt utstyr dekontamineres. Søl av organisk materiale på flater desinfiseres med 2 N natriumhydroksid i 1 time.
Fram til dags dato er det, med bakgrunn i humane autopsier, oppdaget smitte (PrPSc) i gingiva og spyttkjertler i svært små doser (100 ganger mindre enn i hjernen). Prioner er påvist i pulpavev, men ikke i sykdomsassosiert form (PrPSc) (13). Manglende påvisning av PrPSc i pulpavev kan ha sammenheng med sensitivitet på dagens analysemetoder. I noen autopsier var nivået 1/1000 av nivået i gingiva og spyttkjertelvev. En har ikke funnet infeksjonsagens i saliva (13). Dosen som skal til for smitteoverføring er ukjent. I en studie ble prioninfisert materiale (263K strain av scrapie) inokulert i pulpa på hamster, noe som førte til at alle dyrene ble smittet, og en fant spredning av sykdommen til trigeminusgangliet via aksonal transport (14). Dette er også vist motsatt vei ved intracerebral inokulering og transport av smitte til tunge (15).
Ettersom det eksisterer en viss risiko for at pasienter med en form for CJD kan komme til tannbehandling, bør tannleger kunne identifisere denne type pasienter for å ta forholdsregler og redusere risiko for kryss-smitte.
For at det skal være mulig å identifisere slike pasienter må følgende historie være kjent:
1. Fullstendig medisinsk pasienthistorie
2. Familiehistorie inklusiv informasjon vedrørende prionsykdom
3. Reisehistorie for å avdekke eventuell eksponering under besøk til endemiske områder (for eksempel Storbritannia)
Basert på disse data kan pasienter identifiseres til å ha høy eller lav risiko når det gjelder å utvikle sykdom (16). Høyrisikopasienter inkluderer pasienter med påvist diagnose eller mistanke om CJD, asymptomatiske pasienter med en genmutasjon, alle medlemmer hos familier der en har et tilfelle av fCJD, og alle medlemmer av familier med et tilfelle av vCJD (ettersom en mangler kunnskap om etiopatogenese) (16).
Lavrisikopasienter er de med udiagnostisert nevrologisk sykdom, med eller uten demens, medlemmer av familier med en historie relatert til udiagnostisert demens eller neurologisk sykdom, mottakere av hypofysehormoner (veksthormoner eller gonadotropiner) eller dura mater, og pasienter utsatt for transdural kirurgi mellom 1972 og 1989 ettersom infeksiøse agens kunne bli overført under disse inngrepene (16).
Anbefalinger for prion-inaktivering
Regler for behandling av vev med høy smitterisiko
Organiske vevsrester og alle instrumenter eksponert for infeksiøst vev må destrueres ved brenning, da dette er den eneste sikre måte å eliminere prioner. Kjemisk sterilisering utføres på alle flater hvor en mistenker søl av organisk materiale, alle varmesensitive instrumenter som ikke har vært i direkte kontakt med pasienten, infeksiøst materiale og histopatologiske prøver tatt for histopatologisk undersøkelse. Her brukes 2N natriumhydroksid i 1 time, deretter gjennomskylling med rikelige mengder vann (17).
Histologisk prøvetaking må bare foretas av personale som har kunnskap om smitterisiko. Prøvene må legges i 96 % maursyre i en time og merkes med «risikovevsprøve». Tilslutt benyttes fysisk sterilisering av alle varmeresistente instrumenter som ikke har vært i kontakt med infeksiøst vev. Her kan autoklav brukes. Autoklaven må rengjøres med etanol eller formaldehyd før videre bruk. Autoklaven må virke i 18 minutter med en temperatur på 134 – 138C. Instrumentene må deretter ligge i en oppløsning av natriumhydroksid eller natriumhypokloritt med konsentrasjon på 20 000 ppm (5).
Ved behandling av pasienter i høyrisikogruppen må alt materiale som har vært i kontakt med pasienten brennes. Instrumenter som har vært brukt, må oppbevares separat til en har fått verifisert diagnosen før eventuell destruering ved brenning. Har en mistanke om sykdom, er det anbefalt at disse pasientene ikke bruker samme spyttfontene som andre pasienter, men heller bruker et engangsbeger som kan brennes (13, 18).
Generelle regler for tannbehandling
Sannsynligheten for å overføre vCJD ved vanlig tannbehandling er en milliondel mindre enn ved tonsillektomi (19). Vi vet imidlertid at infisert materiale adhererer til stålinstrumenter og bevarer sin patogenisitet. På bakgrunn av dette anbefaler WHO i sine protokoller engangsutstyr ved invasive inngrep (19).
Siden det ikke er påvist noen kontaktsmitte mellom mennesker via luft eller saliva, er det ingen spesielle retningslinjer som gjelder for tannleger, annet enn at en tar høyde for inaktivering av eventuelle prioner på instrumenter, og følger retningslinjene som beskrevet av Folkeheleinstituttet hvor invasive instrumenter bør destrueres (6).
Sterilisering av endodontiske instrumenter
Gjenbruk av rotkanalinstrumenter er avhengig av rengjøring og sterilisering. Selv nye instrumenter er vist å være kontaminert og bør derfor rengjøres og steriliseres før bruk (20). Endodontiske instrumenter har en kompleks struktur og er i kontakt med perifere deler av n. trigeminus. I tillegg er det vist at prionproteiner lett adherer til overflater av stål, og er resistente for mange dekontamineringsmetoder (21). Når det gjelder tannbehandling, har det oppstått bekymring rundt endodontisk behandling ettersom instrumenter som kommer i kontakt med pulpavev og endegrener av nervus trigeminus kan presentere en risiko for prionsmitte.
Metoder for rengjøring av rotkanalinstrumenter kan være mangelfulle når det gjelder fjerning av biologisk material. En undersøkelse fra Storbritannia (22) viste at 76 % (22/29) av endodontiske filer hentet fra allmennpraksis inneholdt biologisk materiale, mot 14 % av filer (5/37) fra en tannklinikk tilhørende et sykehus. Dette var studert etter at rengjøringsprosedyrer og dekontamineringsmetoder var utført. Filene ble undersøkt under elektronmikroskop. De endodontiske instrumentene hentet fra allmennpraksis var rengjort manuelt med håndbørsting før autoklavering, mens instrumentene fra kirurgisk avdeling var dekontaminert med rensemiddel i ultralydsbad, og deretter autoklavert to ganger.
Over 1 million endodontiske behandlinger utføres hvert år i England og Wales (22). Resultatet fra denne undersøkelsen viser at dagens dekontamineringsmetoder av endodontiske instrumenter brukt i allmenn praksis og sykehus er ufullstendig med tanke på fjerning av biologisk materiale. Vi har ingen tilsvarende studie fra Norge, men våre prinsipper for rengjøring og sterilisering av rotkanalinstrumenter er stort sett de samme. Selv om endodontiske prosedyrer representerer en relativ lav smitterisiko, utgjør mengden av antall endodontiske behandlinger en risiko for at smitte kan forekomme.
Til og med kvalitetssikrede dekontamineringsregimer ved sentrale steriliseringsenheter ved sykehusavdelinger viste små rester av biologisk materiale. Disse funnene er bekymringsfulle i lys av at prioner kan overføres via stålinstrumenter (nok til å overføre sykdom) til tross for vasking og formaldehydbehandling (23).
I Australia har en gruppe studert forskjellige protokoller for rengjøring av rotkanalinstrumenter (20). Basert på dette arbeidet foreslås det en kombinasjon av de mest effektive rengjøringsprosedyrene for å oppnå stor grad av sikkerhet for rene nikkel-titan (Ni-Ti) instrumenter før sterilisering (Tabell 3). Makroskopisk var der ingen synlige rester av biologisk materiale, og etter innfarging forble 100 % av instrumentene rene (mikroskopisk registrering av farget materiale). Natriumhypokloritt løser effektivt pulpavev, men kan korrodere instrumentene. Den australske studien viste derimot at Ni-Ti var resistent mot korrosjon, men at metallskaftet korroderte i ultralydsbad etter 30 minutter i 1 % og 4 % løsning med natriumhypokloritt (20). Den enzymatiske løsningen som ble brukt i studien er anbefalt til rengjøring av medisinske instrumenter fordi den fjerner proteiner, lipider og karbohydrater fra instrumentoverflaten. Det er mange enzymatiske rensemidler tilgjengelig, men alle krever en kontakttid på minimum 2 – 10 minutter og en minimumstemperatur på 35 – 45C for optimal effekt.
Vannbad med enzymløsning EmPower® (Metrex Research Corporation, Romulus, Michigan, USA) gav gode resultater og eliminerte korrosjonsproblemet. Studien indikerte at bløtgjøring av vevsrester var viktigere enn selve ultralydsbadet, og at 30 minutter gav bedre resultat enn 15 minutter. Studien viste også at bruk av ultralyd var et viktig trinn i rengjøring av instrumenter, og at dette hadde en antimikrobiell effekt. I studien oppnådde en bedre resultat ved lang bløtgjøringstid (30 minutter) og kortere tid i ultralydsbad (15 minutter), noe som kanskje hadde sin årsak i at forurensning redeponeres på instrumenter ved lengre tid i ultralyd (20). Videre er det viktig å skylle godt med vann etter ultralydbehandling for å fjerne kontaminert løsning (20).
Trinn |
Metode |
Middel |
|
|---|---|---|---|
1 |
Kjemo-mekanisk rengjøring ved behandlingsenhet |
Fuktet svamp – 10 drag pr. instrument |
Klorheksidin – 0,2 % |
2 |
Bløtlegging |
30 minutter |
EmPower® enzym løsning* |
3 |
Ultralydsbad |
15 minutter |
EmPower® enzym løsning* |
4 |
Skylling |
20 sekunder |
Rennende vann |
Hvis en i en travel praksis legger for stor vekt på hurtig mekanisk rengjøring framfor bruk av rensemidler og ultralyd, kan resultatet bli dårlig (24). Mekanisk rengjøring må settes inn i et system som muliggjør optimal rengjøring av instrumentene.
Den anbefalte protokollen er tidkrevende (tabell 3), men kan implementeres i tannlegepraksis. Tannhelsepersonell trenger å få innsikt i begrunnelsen for den nitidige rengjøring av flergangsutstyr, underbygget av vitenskapelig dokumentasjon om prionsmitte (25). Protokollen i tabell 3 er utviklet med tanke på en travel privatpraksis, for å underbygge dens praktiske relevans og effektivitet. Videre koster rengjøringsprotokollen ca. 10 % av hva et nytt Ni-Ti-instrument koster. Denne studien viser at det er mulig å få rene instrumenter (makroskopisk), slik det anbefales av australske og new-zelandske myndigheter. Studien viste også at selv «mikroskopisk renhet» kan oppnås, bekreftet ved innfarging med Van Gieson, som farger protein. Denne innfargingen er likevel ikke spesifikk for prioner (amyloid).
På bakgrunn av tilgjengelig litteratur, og smitterisiko, har nasjonale organisasjoner i Storbritannia og Tyskland uttrykt at risiko for smitte rettferdiggjør bruk av engangsutstyr. Centers for Disease Control and Prevention (CDC) i Storbritannia har innført engangsbruk av invasive instrumenter i pasientbehandling, herunder endodontiske instrumenter. I Nederland er det innført et honorar som dekkes av det offentlige for bruk av engangsinstrumenter til endodontisk behandling (45 Euro). Andre land, som USA og Canada, har ingen uttalt politikk på området. Australske myndigheter ser ingen risiko i gjenbruk av endodontiske instrumenter.
Konklusjon
Faren for prionsmitte under tannbehandling i Norge er svært liten. Etablerte rutiner for rengjøring av instrumenter, særlig rotkanalinstrumenter, synes ikke tilstrekkelige. Rengjøringsrutiner bør endres i de fleste praksiser hvis målsettingen er at rotkanalinstrumenter skal brukes flere ganger. Engangsinstrumenter til bruk i rotkanalarbeid i Norge vil lette hverdagen for mange tannlegepraksiser, og dette bør være hovedargument for å innføre engangsinstrumenter mer enn den direkte faren for prionsmitte.
English summary
Kvinnsland SR, Bårdsen A, Fristad I.
Prions and endodontics – re-use or single use of endodontic instruments?
286 – 91.
Root-canal instruments have a structure that makes cleaning and sterilization difficult. In this context, abnormal prion proteins, causing transmissible spongiform encephalopathies, are relatively resistant to normal sterilizations methods. Abnormal prions have the ability to accumulate in the brain and cause Creutzfeldt–Jacobs disease (CJD) in humans. The discussion on single use of endodontic instruments is partly a consequence of this concern. Although epidemiological investigations have not revealed any evidence that dental procedures have led to increased risk of iatrogenic transmission of CJD in humans, infective agents have been detected in oral tissues. For patients with known disease history it is therefore recommended that all instruments should be destroyed by incineration. Procedures for sterilization are poor when it comes to eliminating debris from used instruments. As a consequence, some countries have recommended single use of root canal instruments. As cleaning procedures for endodontic instruments are difficult, single use of endodontic instruments may be encouraged in Norway to facilitate the daily routines in a dental practice more than the ultimate risk for transmission of CJD.
Takk
Takk til forsker Kjetil Bårdsen ved Institutt for produksjonsmedisin – seksjon for småfeforskning, Norges Veterinærhøgskole, for konstruktive innspill til artikkelen.
Hovedbudskap | |
|---|---|
• |
Prionprotein forårsaker varianter av Creutzfeldt-Jacobs sykdom, men risiko for prionsykdom i Norge er liten |
• |
Normal form av prioner kan forekomme i pulpavev, men sykdomsassosiert form av prioner er per i dag ikke påvist |
• |
Rengjøring og desinfeksjon av rotkanalinstrumenter er vanskelig – særlig med tanke på prioner |
• |
Sykdomsassosiert form av prioner er vanskelig å inaktivere ved vanlige steriliseringsprosedyrer |
• |
Engangsbruk av rotkanalinstrumenter vil best sikre brukskontroll |
Referanser
1. Skaug N, Olsen I. Prioner og prionsykdommer – smittefare og smitteforebyggende tiltak ved tannbehandling og oralkirurgiske inngrep. Nor Tannlegeforen Tid. 2001; 111: 924 – 9.
2. Rutala WA, Weber DJ. Infection control: the role of disinfection and sterilization. J Hosp Infect. 1999; 43 Suppl: S43 – 55.
3. Smith AJ, Bagg J, Hurrell D, McHugh S. Sterilization of re-usable instruments in general dental practice. Br Dent J. 2007; 203: E16.
4. Skaug N, Olsen I. Smittevern. Oslo: Den norske tannlegeforening; 2004; http://www.tannlegeforeningen.no/cda/storypg.aspx?id=289& zone=76&parentzone=10&Ver=1] (lest 08.03.2009).
5. Palacios-Sanchez B, Esparza-Gomez GC, Campo-Trapero J, Cerero-Lapiedra R. Implications of prion diseases for dentistry: an update. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008; 105: 316 – 20.
6. Folkehelseinstituttet. Creutzfeldt-Jacobs sykdom og andre prionsykdommer. Oslo: Folkehelseinstituttet; 2008; http://www.fhi.no/eway/default aspx?pid=233&trg=MainLeft_5799&MAinArea_661 (lest 24.10.2008).
7. Azarpazhooh A, Leake JL. Prions in dentistry – what are they, should we be concerned, and what can we do? J Can Dent Assoc. 2006; 72: 53 – 60.
8. Ersdal C, Ulvund MJ, Espenes A, Benestad SL, Sarradin P, Landsverk T. Mapping PrPSc propagation in experimental and natural scrapie in sheep with different PrP genotypes. Vet Pathol. 2005; 42: 258 – 74.
9. Turner ML, Ludlam CA. An update on the assessment and management of the risk of transmission of variant Creutzfeldt-Jakob disease by blood and plasma products. 2008; [http://www.ncbi.nlm.nih.gov/entrez/query fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=18950452 (lest 15.12.2008).
10. Spongiform Encephalopathy Advisory Committee (SEAC). vCJD and Dentistry. 2007; www.seac.gov.uk/statements/state-vcjd-dentistry.htm (lest 18.11.2008).
11. Economics and Operational Research Division (EOR4). Risk assessment for vCJD and dentistry. London: The UK Department of Health; 2003.
12. Spongiform Encephalopathy Advisory Committee (SEAC). Position statement vCJD and Endodontic dentistry. 2006; www.seac.gov.uk/statements/statement0506.htm (lest 13.11.2008).
13. Head MW, Ritchie D, McLoughlin V, Ironside JW. Investigation of PrPres in dental tissues in variant CJD. Br Dent J. 2003; 195: 339 – 43.
14. Ingrosso L, Pisani F, Pocchiari M. Transmission of the 263K scrapie strain by the dental route. J Gen Virol. 1999; 80: 3043 – 7.
15. Mulcahy ER, Bartz JC, Kincaid AE, Bessen RA. Prion infection of skeletal muscle cells and papillae in the tongue. J Virol. 2004; 78: 6792 – 8.
16. Bebermeyer RD, Powell JF, Hobdell MH, Durban EM. Dental practice implications of prion diseases. Quintessence Int. 2003; 34: 38 – 44.
17. Centers for Disease Control and Prevention. Guidelines for Infection Control in Dental Healthcare Settings – 2003. 2003; http://www.cdc.gov/mmwr/preview/mmwrhtml/rr5217a1.htm (lest 08.10.2008).
18. Scully C, Smith AJ, Bagg J. Prions and the human transmissible spongiform encephalopathies. Dent Clin North Am. 2003; 47: 493 – 516.
19. Porter SR. Prion disease: possible implications for oral health care. J Am Dent Assoc. 2003; 134: 1486 – 91.
20. Parashos P, Linsuwanont P, Messer HH. A cleaning protocol for rotary nickel-titanium endodontic instruments. Aust Dent J. 2004; 49: 20 – 7.
21. Bagg J, Sweeney CP, Roy KM, Sharp T, Smith A. Cross infection control measures and the treatment of patients at risk of Creutzfeldt Jakob disease in UK general dental practice. Br Dent J. 2001; 191: 87 – 90.
22. Smith A, Dickson M, Aitken J, Bagg J. Contaminated dental instruments. J Hosp Infect. 2002; 51: 233 – 5.
23. Zobeley E, Flechsig E, Cozzio A, Enari M, Weissmann C. Infectivity of scrapie prions bound to a stainless steel surface. Mol Med. 1999; 5: 240 – 3.
24. Burkhart NW, Crawford J. Critical steps in instrument cleaning: removing debris after sonication. J Am Dent Assoc. 1997; 128: 456 – 63.
25. Reichert M. Reuse of single-use devices. A program model. Nurs Clin North Am. 1993; 28: 697 – 709.
26. Pan KM, Baldwin M, Nguyen J, Gasset M, Serban A, Groth D, et al. Conversion of alpha-helices into beta-sheets features in the formation of the scrapie prion proteins. Proc Natl Acad Sci U S A. 1993; 90: 10962 – 6.
27. Centres for Disease Control and Prevention. 2008; www.cjd.ed.ac.uk/ (lest 13.11.2008).
Adresse: Asgeir Bårdsen, Institutt for klinisk odontologi – endodonti, Universitetet i Bergen, Årstadveien 17, 5009 Bergen. E-post: asgeir.bardsen@iko.uib.no
Artikkelen har gjennomgått ekstern faglig vurdering.