Kan bruk av triklosanholdige produkter bidra til utvikling av resistente bakterier?
Forfattere
Institutt for oral biologi, Det odontologiske fakultet, Universitetet i Oslo
Vitenskapskomiteen for mattrygghet, Oslo
Nasjonalt folkehelseinstitutt, Oslo
Nasjonalt institutt for ernærings- og sjømatforskning, Bergen
Matforsk AS, Ås
Vitenskapskomiteen for mattrygghet, Oslo
Matforsk AS, Ås
Veterinærinstituttet, Oslo
Artikkelen er omarbeidet fra en artikkel tidligere publisert i tidsskriftet Microbial Drug Resistance (1)
Triklosan er et mye benyttet baktericid med et bredt antimikrobielt spekter. Triklosan inkorporeres i mange forbruksartikler og personlige hygieneartikler for konservering og for antibakteriell effekt. På bakgrunn av en risikovurdering av mulig resistensutvikling i sykdomsfremkallende bakterier ved bruk av triklosan, ba Mattilsynet i 2005 EU-kommisjonen forby stoffet i kosmetiske produkter som for eksempel tannpasta. EUs vitenskapskomité for forbrukerprodukter vedtok i oktober 2006 å stille seg avventende til et eventuelt forbud.
Denne artikkelen er basert på systematisk søk og analyse av relevante vitenskapelige artikler, og diskuterer en mulig sammenheng mellom bruk av triklosan og utvikling av resistens i medisinsk viktige bakterier.
Ved baktericide konsentrasjoner virker triklosan uspesifikt på mange bakterielle mål. Det er imidlertid bekymringsfullt at subletale doser kan føre til utvikling av resistens mot triklosan og en ko-resistens mot andre klinisk relevante antibiotiske og antimikrobielle stoffer. Utstrakt bruk av triklosan kan således representere en helsefare. Bruken bør derfor reduseres til klare indikasjoner der man kan forvente å oppnå ønsket effekt med minst mulig risiko for resistensutvikling.
En ekspertgruppe engasjert av Vitenskapskomiteen for mattrygghet vurderte i 2005 risikoen for mulig resistensutvikling i sykdomsfremkallende bakterier ved bruk av triklosan. På bakgrunn av konklusjonene, ba Mattilsynet EU-kommisjonen forby triklosan i kosmetiske produkter, som for eksempel tannpasta. EUs vitenskapskomité for forbrukerprodukter vedtok i oktober 2006 å stille seg avventende til et eventuelt forbud. Saken er imidlertid ikke avsluttet, idet Mattilsynet har bedt ekspertgruppen om å vurdere den i lys av EUs svar og eventuell relevant litteratur publisert etter 2005. Denne artikkelen er skrevet av ekspertgruppen og er basert på systematisk søk og analyse av relevante vitenskapelige artikler (1) samt risikovurderingsrapporten (2). En mulig sammenheng mellom bruk av triklosan og utvikling av resistens i medisinsk viktige bakterier blir diskutert.
Hva er triklosan og hvordan virker det?
Triklosan ble fremstilt som et antibakterielt middel av Ciba Geigy Company tidlig på 1960-tallet. Siden har triklosan blitt tilsatt stadig flere produkter, delvis som preserveringsmiddel og delvis pga. sine egenskaper som desinfeksjonsmiddel og antiseptikum. Triklosan er aktivt først og fremst mot grampositive bakterier, men har også en viss effekt på enkelte gramnegative bakterier, sopp og virus. På grunn av sin bredspektrede effekt blir triklosan tilsatt en rekke personlige hygieneartikler slik som såper, sjampo, kremer, deodoranter, munnskyllevann, tannpastaer og tannbørsteskaft. I tillegg brukes triklosan i husholdningsartikler som vaskemidler og kjøkkenredskaper, og til tekstiler slik som sports- og babyklær, puter, madrasser, tepper, gulvbelegg, maling og annet. Triklosanholdige håndvaskemidler benyttes i helsevesenet for å redusere faren for nosokomiale infeksjoner. Triklosanholdig tannpasta er den viktigste kilden til triklosaneksponering i befolkningen (2).
Triklosan er et difenyleter-derivat med både hydrofobe og hydrofile egenskaper (Figur 1). Molekylet er non-ionisk, uten lukt og smak og er lite løselig i vann. Det løses derimot i detergenter. Triklosan ble inntil nylig ansett som et biocid som angriper bakterier på en uspesifikk måte, med flere angrepsmål (1). Stoffer med slik virkningsmekanisme regnes ikke å føre til resistensutvikling i bakterier. Nyere studier viser imidlertid at subletale konsentrasjoner av triklosan hemmer enzymet enoyl-acyl bæreprotein-reduktase (3). Enzymet er nødvendig i bakterienes syntese av fettsyrer og dannelsen av fosfolipider til cellemembranen.
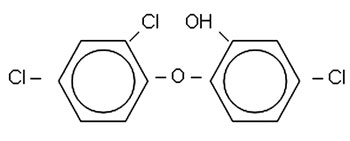
Figur 1. Triklosan (2,4,4´-trikloro-2´-hydroksydifenyleter). Som handelsnavn benyttes følgende; Microban, Irgasan DP-300, Aquasept, Sapoderm, Actisan, Tinosan, Lexol, Ster-Zac, Irgacid, Irgaguard, Irga-care.
Hva vet vi om triklosanbruk og mulig resistensutvikling?
Vanlig brukte konsentrasjoner av triklosan er vesentlig høyere enn nødvendig for å drepe bakterier. På dette grunnlag har man vurdert resistensutvikling mot triklosan som usannsynlig. Imidlertid viser det seg at rester av triklosan blir liggende igjen etter bruk, med den konsekvens at triklosan over tid og med økende avstand til appliseringsstedet kan bli fortynnet til subletale konsentrasjoner. I tannpastaer og munnskyllevann tilsettes stoffer med den hensikt å retinere triklosan i munnen for å forlenge den antimikrobielle effekten. Dette fører til at mikroorganismer i munnhulen utsettes for subletale triklosandoser, med større mulighet for resistensutvikling.
Mikrobiell triklosanresistens kan bero på en naturlig egenskap ved enkelte bakterier, eller den kan erverves ved genetiske endringer i bakterien (Figur 2). Den naturlige resistensen eller nedsatte følsomheten mot triklosan kan bero på at bakteriens membran er impermeabel for triklosan, at triklosan brytes ned enzymatisk, at enzymet enoyl-reduktase ikke er sensitivt, eller at bakterien har efflux-mekanismer som pumper triklosan ut av cellen (Figur 2) (4, 5). Enterococcus faecalis og Streptococcus pneumoniae er naturlig resistente mot triklosan (6). Bruk av triklosan kan derfor bidra til å selektere disse bakteriene. E. faecalis hører til human normalflora, men er også patogen og årsak til mer enn ti prosent av rapporterte tilfeller av sykehusinfeksjoner (7). S. pneumoniae er en viktig årsak til sykdom og død i befolkningen og den økende forekomsten av resistente stammer skaper problemer for effektiv terapi (8).
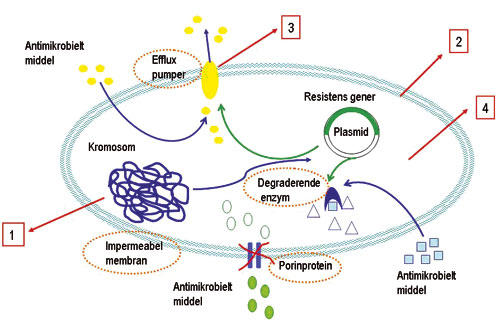
Figur 2. Mulige mekanismer for naturlig og ervervet bakteriell resistens. Naturlig resistens (stiplet orange ovaler) inkluderer impermeabel membran, efflukspumper, degraderende enzymer. Ervervet resistens (røde firkantbokser) inkluderer 1) Mutasjon i fab1- eller det homologe inhA-genet som koder for enzymer som er viktige i bakteriens produksjon av cellemembran. Mutasjon i disse genene har vist å gi triklosanresistens i E. coli (3, 9), S. aureus (10) og M. tuberculosis (11, 12). 2) En annen resistensmekanisme er økt ekspresjon av fab1-genet; slik man har sett i kliniske isolater av S. aureus (13). 3) Økt aktivitet av efflux-pumper eller overproduksjon av slike pumper som eksporterer antibakterielle stoffer ut av cellen, kan induseres av subletale doser av stoffet. Dette er påvist ved eksponering og har medført redusert sensitivitet overfor triklosan. 4) I tillegg finnes det sannsynligvis andre, ukjente resistensmekanismer.
Generelt sett kan bakterier erverve resistens via en rekke ulike mekanismer (Figur 2) (1). Dette gjelder også for utvikling av resistens mot triklosan. Mutasjon i genet (fabI), eller det homologe genet (inhA) som koder for enoyl-acyl bærerprotein reduktase, gir triklosanresistens i E. coli (3, 9), S. aureus (10) og M. tuberculosis (11, 12). Enoyl-acyl bærerprotein- reduktase er viktig i bakteriens produksjon av cellemembran. En annen resistensmekanisme er økt ekspresjon av fabI-genet; slik man har sett i kliniske isolater av S. aureus (13). Økt aktivitet av efflux-pumper eller overproduksjon av slike pumper som eksporterer antibakterielle stoffer ut av cellen, kan induseres av subletale doser av stoffet. Dette er påvist ved eksponering og har medført redusert sensitivitet overfor triklosan. I tillegg finnes det sannsynligvis andre, ukjente resistensmekanismer.
Normalflorabakterier utgjør et reservoar av resistensgener som potensielt kan overføres til andre bakterier, for eksempel humane patogener (14). Siden triklosan hovedsakelig inkorporeres i personlige hygieneprodukter, og ellers har få kliniske applikasjoner, foretas det imidlertid ikke rutinemessig sensitivitetstesting av bakterier overfor triklosan.
Triklosanresistens hos ulike bakterier
Oral mikroflora
Tilsetning av triklosan til munnhygieneprodukter slik som tannpasta og munnskyllevann, har til hensikt å redusere bakterietallet i munnen for å redusere mengden plakk, og hindre blant annet gingivitt. Plakket utgjør en kompleks biofilm bestående av et stort antall ulike bakterier. Kontroll med denne biofilmen er avgjørende for å opprettholde en god tannhelse. For at antibakterielle munnhygienemidler skal være effektive, må de retineres i munnen over en viss tid. Retensjonstiden for triklosan i munnhulen er i utgangspunktet lav. For å motvirke rask utvasking av triklosan, tilsettes derfor ulike retensjonsstoffer. Uten disse tilsetningsstoffene har triklosan liten effekt (15). Det foreligger en rekke studier av triklosanholdige tannhelseprodukters effekt på plakk og gingivitt. En meta-analyse av seksten kliniske studier indikerte at slike produkter kan redusere mengden plakk med femten prosent og gingivitt med tolv prosent (1). Det foreligger ingen dokumentert karieshemmende effekt av triklosan, men tannpasta med triklosan er rapportert å være «minst like god» som annen fluorholdig tannpasta (16).
Triklosansensitivitet hos orale bakterier er også undersøkt i en rekke studier, men en mulig kryssresistensutvikling er viet liten oppmerksomhet. Walker og medarbeidere fant ingen signifikant endring i flora eller floraens sensitivitet hos personer som brukte triklosanholdig tannpasta i seks måneder (17). Jones og medarbeidere fant ingen tegn til triklosanresistens i floraen hos forsøkspersoner etter syv måneders bruk av triklosanholdig tannpasta (18). I en gjennomgang av ni kliniske studier fant Sreenivasan og Gaffar ingen holdepunkter for at triklosanbruk hadde ført til endringer i den orale bakterieflora eller at triklosanresistente bakterier hadde utviklet seg (19).
Orale streptokokker utgjør en stor andel av normalfloraen i munnhulen. De utgjør et viktig forsvar mot kolonisering av patogene bakterier. På den annen side utgjør de orale streptokokkene en kilde til genetisk materiale som kan overføres ved horisontal genoverføring til andre bakterier som således kan bli resistente. Dette har skjedd i høy grad for eksempel med S. pneumoniae (20).
Det hersker ulikt syn på bruk av antimikrobielle midler for å forebygge tannsykdommer. Det er en fare for at slike stoffer kan forrykke den økologiske balansen i munnhulen og derved føre til seleksjon av resistente bakterier. I motsetning til de fleste andre infeksjoner, forårsakes tannsykdommer av medlemmer av normalfloraen som også har en viktig funksjon i infeksjonsforsvaret. Man kan derfor spørre om det er hensiktsmessig med daglig bruk av triklosanholdige tannhelseprodukter i den generelle befolkningen. Effekten av triklosanholdig tannpasta på oral helse er begrenset (21) og synes å være uavhengig av den antimikrobielle effekten av triklosan (1).
Tarmflora
Noe triklosan som er tilsatt dentale produkter vil svelges. Studier av klorheksidins farmakokinetikk har vist at ca. tre prosent blir svelget umiddelbart og 67 prosent blir spyttet ut. De ca. 30 prosentene som retineres i munnen vil frigjøres over tid og deretter svelges. Det er ikke gjort tilsvarende farmakokinetiske studier av triklosan. Man vet imidlertid at triklosan absorberes fra tarmen, og skilles ut i urinen. Triklosan gjenfinnes i de fleste kroppsvæsker, inkludert brystmelk og plasma (1).
Mulig utvikling av triklosanresistens hos tarmbakterier er først og fremst studert in vitro ved at tarmbakterier er eksponert for triklosan under laboratoriebetingelser. At triklosan angriper et spesifikt mål, ble først oppdaget i et slikt forsøk i en laboratoriestamme av E. coli (3). Stammer av Salmonella enterica og E. coli O157 adaptert til å vokse i nærvær av triklosan, ble også resistente mot andre antimikrobielle midler. For eksempel ble S. enterica serovar Enteritidis resistent mot kloramfenicol, mens serovar Typhimurium ble resistent mot klorheksidin. Sub-inhibitoriske konsentrasjoner av biocider slik som triklosan, førte til seleksjon av S. enterica-stammer med nedsatt sensitivitet overfor klinisk relevante antibiotika som ampicillin, ciprofloksacin og tetracyclin (22). Triclosanadapterte og -resistente E. coli O157 viste redusert sensitivitet overfor en rekke antibiotika, inkludert ciprofloxacin, kloramfenicol, tetracyclin, amoxicillin og trimetoprim, og også mot biocider som benzalkoniumklorid og klorheksidin (23, 24). Resistens og kryssresistensprofilen varierer fra stamme til stamme blant E. coli-stammer. E. coli O157 viser økt virulens i forhold til E. coli K-12 og E. coli O55: H7 og også en større tendens til kryssresistensutvikling ved eksponering for triklosan (24). Også humane og animalske Campylobacter spp som er resistente mot triklosan, viser kryssresistens mot en rekke andre antimikrobielle midler (25). Det ble nylig bekreftet at E. coli utvikler nedsatt sensitivitet mot triklosan ved hyppig eksponering. Dette syntes imidlertid å skje i liten grad i andre bakteriestammer. Likeledes syntes kryssresistens å være et sjeldent fenomen i denne studien (1).
Hudflora
Triklosan kommer i kontakt med hud via en rekke personlig hygieneprodukter samt dermatologiske produkter brukt i helsevesenet. Huden er kolonisert av et stort antall lavvirulente bakterier som under normale forhold sjelden er årsak til infeksjoner. Koagulasenegative Staphylococcus epidermidis utgjør en stor andel av hudfloraen. Som opportunist er den en viktig sykehuspatogen og forårsaker infeksjoner blant annet på medisinske fremmedlegemer og implantater. Koagulasepositive S. aureus er en viktig årsak til hud- og sårinfeksjoner. Hudfloraen er under et stadig seleksjonspress ved eksponering for antimikrobielle stoffer via dermatologiske produkter. Dette kan føre til utvikling av resistente bakteriestammer. Flere studier har påvist redusert sensitivitet for triklosan blant S. aureus-isolater (26 – 28). Den raske utviklingen og spredningen av resistens blant S. aureus- stammer representerer et stort og økende klinisk problem. Det har vært mindre fokus på resistensutvikling hos de koagulasenegative stafylokokkstammene. En nylig publisert studie viste imidlertid at triklosanresistens var mer utbredt blant methicillinresistente S. epidermidis-stammer enn blant S. aureus- stammer (29). Dette kan skyldes ulike mekanismer for resistensutvikling eller ulik eksponering for triklosanholdige produkter.
Bakterier i miljøet
Det foreligger et begrenset antall studier av triklosanresistens blant miljøbakterier. De to jordbakteriene, Pseudomonas putida og Alcaligenes xylosoxidans ssp. denitrificans, som kan forårsake opportunistiske sykehusinfeksjoner, er resistente mot triklosan ved at de produserer enzymer som bryter ned triklosan (4). Likeledes er Stenotrophomonas maltophilia, som kan finnes i sputum fra pasienter med cystisk fibrose, en viktig nosokomial multiresistent patogen med opphav i vann, jord, planter og matvarer (30). Helsepersonells hender, ismaskiner, vasker, dusjhoder, desinfeksjonsmidler, intravenøse væsker og hjerte- og dialyseutstyr kan være kilde til denne bakterien på sykehus. Det ble nylig vist at triklosaneksponering kan selektere S. maltophilia- stammer med overproduksjon av en multiresistenspumpe (31). Enkelte S. maltophilia-stammer kan overføre resistensgener til andre bakterier, slik som P. aeruginosa, Enterobacteriaceae og Proteus mirabilis (1). Dette kan medføre fare for spredning av resistensgener, særlig når S. maltophilia finnes i polymikrobielle infeksjoner eller i normalflora.
Utstrakt bruk av triklosan i husholdning, industri og helsevesen fører til spredning av triklosan til miljøet via avløpsvann. Subletale konsentrasjoner av triklosan i miljøet kan føre til utvikling av triklosanresistens og muligens til kryssresistens mot andre antimikrobielle midler.
Forbindelse mellom triklosanresistens og resistens mot andre antimikrobielle stoffer
Triklosanresistens kan medføre resistens også mot andre antimikrobielle stoffer. Mycobacterium smegmatis,som var gjort resistent mot triklosan, viste seg også å være resistente motisoniazid, det viktigste middelet mot tuberkulose (12). Mange av efflukspumpene som bidrar til triklosanresistens er relativt uspesifikke i sin gjenkjennelse av substrat. Dette kan medføre at bakteriene er i stand til å pumpe ut, ikke bare det stoffet de opprinnelig ble resistente mot, men også en rekke andre antimikrobielle stoffer (32). Bredspektrede efflukspumper kan således gi multiresistens. Chuanchuen og medarbeidere viste at triklosan var substrat for tre forskjellige efflukspumper i P. aeruginosa (5). De viste videre at eksponering for triklosan selekterte multiresistente mutanter via oppregulering av slike pumper. Motsatt var mutanter med defekte effluxpumper sensitive for triklosan. Resistens kunne overføres til sensitive stammer via overføring av gener som koder for slike pumper. Det har vært spekulert i at utstrakt bruk av lave doser triklosan selekterer bakterier med bredspektrede effluxpumper (9).
Meticillinresistente S. aureus isolert fra pasienter som fikk triklosanholdige bad daglig, var også resistente for mupirocin via plasmidoverført resistens (26). Andre studier har ikke bekreftet denne sammenhengen mellom triklosanresistens og mupirocinresistens. Ikke desto mindre ble det funnet mange stammer med resistens mot lave konsentrasjoner av triklosan. Det ble ikke funnet forskjell i antall triklosanresistente stammer blant methicillinresistente og methicillinsensitive S. aureus (27). Heller ikke i en klinisk studie fra Storbritannia ble det funnet noen sammenheng mellom triklosanbruk og seleksjon av meticillinresistente S. aureus (28).
Til tross for observasjoner av kryssresistens mellom triklosan og andre antimikrobielle stoffer i E. coli og Salmonella i laboratoriestudier (23, 24), har man ikke kunnet bekrefte noen sikker sammenheng klinisk, mellom triklosan-resistens og resistens mot andre antimikrobielle stoffer. Dette utelukker likevel ikke at en slik sammenheng kan eksistere. Kun et fåtall studier har belyst dette spørsmålet.
Kunnskapsbehov
Biofilmbakterier er langt mer resistente mot antimikrobielle stoffer enn frittflytende bakterier. Vi regner også med at biofilmmiljøet er velegnet for overføring av gener mellom bakterier. Mye av kunnskapen vi har om resistensutvikling og triklosanresistens stammer fra laboratoriestudier av bakterier i flytende medier. Flere studier av mulig resistens og kryssresistensutvikling av bakterier som vokser i biofilm er derfor påkrevet. Likeledes har vi lite kunnskap om triklosans effekt på ikke-dyrkbare bakterier. Disse utgjør en stor del av bakteriefloraen i munnhulen, tarmen, på huden og i miljøet, og kan være en viktig DNA-kilde for overføring av resistensgener til potensielt patogene bakterier.
Konklusjon
Den utstrakte bruken av desinfeksjonsmidlet triklosan med eksponering til store befolkningsgrupper de siste årene, oftest uten at ønsket effekt er godt dokumentert, er betenkelig. Triklosan burde derfor ikke brukes uten at den tilsiktede positive effekten er klar. Triklosan fra avløpsvann gjenfinnes i naturen. Økologiske og andre bivirkninger bør minimaliseres. Triklosan i høye konsentrasjoner virker som et bredspektret biocid med mange angrepsmål og bred antimikrobiell effekt, og er derved velegnet i noen kliniske situasjoner. I subletale doser virker imidlertid triklosan mer spesifikt. Dette fører til at bakterier kan utvikle ulike resistensmekanismer mot triklosan. Ved bruk av triklosan selekteres triklosantolerante og triklosanresistente bakterier. Disse kan også ha utviklet multiresistens mot klinisk relevante antibiotika – en resistens som kan spres ved overføring av gener til andre bakterier. Utstrakt bruk av triklosan kan derfor representere en potensiell helsefare. Triklosan bør kun brukes på klare indikasjoner i tilfeller der man kan oppnå en ønsket effekt uten risiko for resistensutvikling.
Hovedbudskap | |
|---|---|
• |
Triklosanbruk kan føre til økt resistens hos bakterier |
• |
Triklosanresistens kan videre føre til redusert sensitivitet overfor klinisk relevante antibiotiske stoffer |
• |
Triklosanbruk bør begrenses og kun skje på klare indikasjoner |
English summary
Scheie AAa, Yazdankhah SP, Høiby AE, Lunestad BT, Heir E, Fotland TØ, Naterstad K, Kruse H.
May use of triclosan-containing products lead to antibacterial resistance?
140 – 4.
Triclosan is a widely used biocide with antimicrobial effect against various bacteria. It is included in many contemporary consumer and personal health care products, like oral and dermal products, but also in household items such as soaps and dishwashing liquids as well as plastics and textiles. At bactericidal concentration, triclosan appears to act upon multiple non-specific targets, disrupting bacterial cell wall functions, while at sub-lethal concentrations, triclosan affects specific bacterial targets. A number of studies have verified the occurrence of triclosan resistance in dermal, intestinal, and environmental bacterial species. Of major concern is the possibility that triclosan resistance may contribute to reduced sensitivity to clinically important antimicrobials, due to either cross-resistance or co-resistance mechanisms. While the number of studies elucidating the association between triclosan resistance and resistance to other antimicrobials in clinical isolates has been limited, recent laboratory studies have confirmed the potential for such a link in Escherichia coli and Salmonella enterica.Thus, widespread use of triclosan represents a potential public health risk. The use of triclosan should be restricted to cases where there is a well documented intended effect. This will contribute to the prevention of development and spread of resistance to triclosan and other antimicrobials.
Referanser
1. Yazdankhah SP, Scheie AA, Hoiby EA, Høiby AE, Lunestad BT, Heir E, Fotland TØ, Naterstad K, Kruse H. Triclosan and antimicrobial resistance in bacteria: an overview. Microb Drug Resist 2006; 12: 83 – 90.
2. Vitenskapskomiteen for mattrygghet V. Risikovurdering av bruken av triklosan i kosmetiske produkter. (http://www.vkm.no/eway/library/openForm.aspx?param1=15828¶m5=read) (Avlest 20.01.2007)
3. McMurry LM, Oethinger M, Levy SB. Triclosan targets lipid synthesis. Nature 1998; 394: 531 – 2.
4. Meade MJ, Waddell RI, Callahan TM. Soil bacteria Pseudomonas putida and Alcaligenes xylosoxidans subsp. denitrificans inactivate triclosan in liquid and solid substrates. FEMS Microbiol Lett 2001; 204: 45 – 8.
5. Chuanchuen R, Beinlich K, Hoang TT, Becher A, Karkhoff-Schweizer RR, Schweizer HP. Cross-resistance between triclosan and antibiotics in Pseudomonas aeruginosa is mediated by multidrug efflux pumps: exposure of a susceptible mutant strain to triclosan selects nfxB mutants overexpressing MexCD-OprJ. Antimicrob Agents Chemother 2001; 45: 428 – 32.
6. Heath RJ, Rock CO. A triclosan-resistant bacterial enzyme. Nature 2000; 406: 145 – 6.
7. Jones RN, Marshall SA, Pfaller MA, Wilke WW, Hollis RJ, Erwin ME, et al. Nosocomial enterococcal blood stream infections in the SCOPE Program: antimicrobial resistance, species occurrence, molecular testing results, and laboratory testing accuracy. SCOPE Hospital Study Group. Diagn Microbiol Infect Dis 1997; 29: 95 – 102.
8. Appelbaum PC. Resistance among Streptococcus pneumoniae: Implications for drug selection. Clin Infect Dis 2002; 34: 1613 – 20.
9. McMurry LM, Oethinger M, Levy SB. Overexpression of marA, soxS, or acrAB produces resistance to triclosan in laboratory and clinical strains of Escherichia coli. FEMS Microbiol Lett 1998; 166: 305 – 9.
10. Heath RJ, Li J, Roland GE, Rock CO. Inhibition of the Staphylococcus aureus NADPH-dependent enoyl-acyl carrier protein reductase by triclosan and hexachlorophene. J Biol Chem 2000; 275: 4654 – 9.
11. McMurry LM, McDermott PF, Levy SB. Genetic evidence that InhA of Mycobacterium smegmatis is a target for triclosan. Antimicrob Agents Chemother 1999; 43: 711 – 3.
12. Slayden RA, Lee RE, Barry Cr. Isoniazid affects multiple components of the type II fatty acid synthase system of Mycobacterium tuberculosis. Mol Microbiol 2000; 38: 514 – 25.
13. Fan F, Yan K, Wallis NG, Reed S,Moore TD, Rittenhouse SF, et al. Defining and combating the mechanisms of triclosan resistance in clinical isolates of Staphylococcus aureus. Antimicrob Agents Chemother 2002; 46: 3343 – 7.
14. Barbosa TM, Sb L. The impact of antibiotic use on resistance development and persistence. Drug Resist Updat 2000; 3: 303 – 11.
15. Wara-aswapati N, D Krongnawakul, D Jiraviboon, S Adulyanon, N Karimbux, W Pitiphat. The effect of a new toothpaste containing potassium nitrate and triclosan on gingival health, plaque formation and dentine hypersensitivity. J Clin Periodontol 2005; 32: 53 – 8.
16. Panagakos FS, Volpe AR, Petrone ME, DeVizio W, Davies RM, Proskin HM. Advanced oral antibacterial/anti-inflammatory technology: A comprehensive review of the clinical benefits of a triclosan/copolymer/fluoride dentifrice. J Clin Dent 2005; 16 Suppl: S1 – 19.
17. Walker C, Borden LC, Zambon JJ, Bonta CY, DeVizio W, Volpe AR. The effects of a 0.3 % triclosan-containing dentifrice on the microbial composition of supragingival plaque. J Clin Periodontol 1994; 21: 334 – 41.
18. Jones CL, Ritchie JA, Marsh PD, F. VdO. The effect of long-term use of a dentifrice containing zinc citrate and a non-ionic agent on the oral flora. J Dent Res 1988; 67: 46 – 50.
19. Sreenivasan P, Gaffar A. Antiplaque biocides and bacterial resistance: a review. J Clin Periodontol 2002; 29: 965 – 74.
20. Reichmann P, Konig A, Linares J, Alcaide F, Tenover FC, McDougal L, et al. A global gene pool for high-level cephalosporin resistance in commensal Streptococcus species and Streptococcus pneumoniae. J Infect Dis 1997; 176: 1001 – 12.
21. Edwardsson S, Burman L, Adolfson-Erici M, Bäckman N. Risker och nytta med triklosan tandkräm. Tandläkartidningen 2005; 97: 58 – 64.
22. Randall LP, Cooles SW, Piddock LJ, Woodward MJ. Effect of triclosan or a phenolic farm disinfectant on the selection of antibiotic-resistant Salmonella enterica. J Antimicrob Chemother 2004; 54: 621 – 7.
23. Braoudaki M, Hilton AC. Adaptive resistance to biocides in Salmonella enterica and Escherichia coli O157 and cross-resistance to antimicrobial agents. J Clin Microbiol 2004; 42: 73 – 8.
24. Braoudaki M, Hilton AC. Low level of cross-resistance between triclosan and antibiotics in Escherichia coli K-12 and E. coli O55 compared to E. coli O157. FEMS Microbiol Lett 2004; 235: 305 – 9.
25. Randall LP, Ridley AM, Cooles SW, Sharma M, Sayers AR, Pumbwe L, et al. Prevalence of multiple antibiotic resistance in 443 Campylobacter spp. isolated from humans and animals. J Antimicrob Chemother 2003; 52: 507 – 10.
26. Cookson BD, Farrelly H, Stapleton P, Garvey RP, Price MR. Transferable resistance to triclosan in MRSA. Lancet 1991; 337: 1548 – 9.
27. Bamber AI, Neal TJ. An assessment of triclosan susceptibility in methicillin-resistant and methicillin-sensitive Staphylococcus aureus. J Hosp Infect 1999; 41: 107 – 9.
28. Al-Doori Z, Morrison D, Edwards G, Gemmell C. Susceptibility of MRSA to triclosan. J Antimicrob Chemother 2003; 51: 185 – 6.
29. Schmid MB, Kaplan N. Reduced triclosan susceptibility in methicillin-resistant Staphylococcus epidermidis. Antimicrob Agents Chemother 2004; 48: 1397 – 9.
30. Goss CH, Mayer-Hamblett N, Aitken MI, Rubenfeld GD, Ramsey BW. Association between Stenotrophomonas maltophilia and lung function in cystic fibrosis. Thorax 2004; 59: 955 – 9.
31. Sanchez P, Moreno E, Martinez JL. The biocide triclosan selects Stenotrophomonas maltophilia mutants that overproduce the SmeDEF multidrug efflux pump. Antimicrob Agents Chemother 2005; 49: 781 – 2.
32. Levy SB. Antibiotic and antiseptic resistance: impact on public health. Pediatr Infect Dis J 2000; 19: 10 Suppl. 120 – 2.
Adresse: Anne Aamdal Scheie, Institutt for oral biologi, postboks 1052 Blindern, O316 Oslo . E-post: ascheie@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering