Hvordan påvirkes munnhulen av kreftbehandling?
Forfattere
Det odontologiske fakultet, Avdeling for oral kirurgi og oral medisin, Universitetet i Oslo og Rikshospitalet-Radiumhospitalet
Artikkelen publiseres parallelt i Tidsskrift for Den norske lægeforening nr. 10, 2006
Bakgrunn. Kreftbehandling med cytostatika og/eller stråling mot hode-hals-regionen kan gi akutte og kroniske bivirkninger i munnhulen.
Materiale og metode. Artikkelen er basert på relevante artikler funnet ved søk i Medline samt egne forskningsresultater og erfaringer.
Resultater. De viktigste orale komplikasjonene ved behandling med cytostatika og/eller stråling er mukositt, infeksjon, spyttkjerteldysfunksjon, smaksforstyrrelser, munntørrhet, smerte, karies, trismus, osteoradionekrose og osteonekrose. Osteonekrose i kjevene er nylig satt i sammenheng med bisfosfonatterapi i behandlingen av pasienter med skjelettmetastaser. Tenner og kjever bør saneres for patologiske tilstander før behandling med cytostatika, stråling og/eller bisfosfonater.
Fortolkning. Økt kunnskap og større interesse hos helsepersonell samt integrering av tannhelsepersonell i det onkologiske behandlingsteam er svært viktig for god profylakse og riktig håndtering av munnhulebivirkninger av kreftbehandling.
Leger og sykepleiere viser mindre interesse for munnhulen enn for andre deler av kroppen til pasienter som behandles for kreft, ifølge en svensk doktorgradsstudie (1). Hensikten med denne artikkelen er å rette oppmerksomheten mot og øke interessen for orale komplikasjoner etter cytostatikabehandling og stråling. Orale symptomer og komplikasjoner kan kompromittere selve kreftbehandlingen, gi dårligere livskvalitet, føre til sosial dysfunksjon og innebære sosioøkonomiske problemer (2). Dette kan påvirke både remisjon av sykdom og overlevelse.
Sammenhengen mellom oral helse, generell helse og helserelatert livskvalitet fordrer et multidisiplinært samarbeid der tannhelsepersonell bør integreres i det onkologiske behandlingsteam. På den måten kan orale bivirkninger forebygges og/eller lindres, slik at kreftpasienters munnhulehelse og tannhelse bedres på kort og lang sikt. Kreftpasienter som evalueres og behandles av et team der tannhelsepersonell inngår, får redusert og i mange tilfeller eliminert behandlingsbegrensende toksisitet og oral behandlingsassosiert morbiditet (3).
Munnhulen – en del av kroppen
Det er ingen presis grense mellom munnhulen og resten av kroppen. Likevel finnes det et tradisjonelt skille mellom helse generelt og munnhule- og tannhelse. Helsevesenet i Norge er med på å opprettholde dette kunstige skillet ved at tannhelsetjenesten fortsatt i stor grad er skilt fra den generelle medisinske helsetjenesten. Dette er ikke minst uheldig for kreftpasienter.
Aggressiv cytostatikaterapi og strålebehandling induserer skade ikke bare på kreftceller, men også på normale celler. Munnhulen er spesielt sårbar for direkte og indirekte toksiske effekter av cytostatika og stråling. Den store risikoen for skade skyldes multiple faktorer som munnslimhinnens raske celleomsetning, kompleks mikroflora, spyttkjerteldysfunksjon og traumatisering av bløtvev ved normal oral funksjon (4). De orale komplikasjonene kan være så alvorlige at kreftbehandlingsintensiteten må reduseres, i verste fall er pasienten ikke i stand til å fortsette behandlingen (2).
Epidemiologi og patogenese
Hyppigheten av orale bivirkninger varierer med type kreftbehandling. National Cancer Institute i USA angir følgende estimater: 10 % ved adjuvant kjemoterapi, 40 % ved kurativ kjemoterapi, 80 % ved beinmargstransplantasjon og 100 % ved hode-og-hals-bestråling der munnhulen er involvert (4). Ifølge Kreftregisteret (www.kreftregisteret.no) oppdages det i Norge hvert år ca. 23 000 nye krefttilfeller, ca. 10 000 dør av kreft og mer enn 150 000 mennesker lever med en kreftdiagnose.
Stråling og cytostatika virker både direkte og indirekte toksisk på munnslimhinnen, spyttkjertler, tenner, kjevebein og tyggemuskler (5 – 7). Direkte toksisistet initieres via primær skade av oralt vev. Indirekte toksisitet er forårsaket av myelosuppresjon og/eller immunsuppresjon, tap av vevsbaserte immunceller og tap av beskyttende bestanddeler i saliva (8).
Orale komplikasjoner
Tabell 1 viser akutte og kroniske orale komplikasjoner relatert til behandling med cytostatika eller stråling mot hode-hals-regionen. En optimal tann- og munnhelse uten skade i tenner, kjever, slimhinner og spyttkjertler forebygger og reduserer alvorlighetsgraden til flere av de nevnte komplikasjonene. Alle kreftpasienter som skal behandles med cytostatika eller stråling mot hode-hals-regionen, bør før behandlingsstart undersøkes, vurderes og eventuelt behandles for patologiske forhold i munnhulen (Ramme 1).
Cytostatika |
Stråling |
||||
|---|---|---|---|---|---|
Komplikasjon/effekt |
Akutt |
Kronisk |
Akutt |
Kronisk |
|
Mukositt |
+ |
– |
++ |
– |
|
Infeksjon |
+ |
– |
+ |
+ |
|
Spyttkjerteldysfunksjon |
+ |
? |
++ |
++ |
|
Munntørrhet |
+ |
? |
++ |
++ |
|
Smaksforstyrrelser |
++ |
– |
++ |
+ |
|
Karies |
– |
+ |
– |
++ |
|
Periodontal sykdom |
– |
+ |
– |
+ |
|
Blødning |
+ |
– |
+ |
– |
|
Osteo(radio)nekrose1 |
– |
– |
– |
+ |
|
Smerte |
+ |
– |
++ |
? |
|
Trismus |
– |
– |
– |
+ |
|
Dentale og skeletale vekstforstyrrelser (barn) |
– |
+ |
+ |
++ |
|
Ny primær kreftsykdom |
– |
– |
– |
+ |
|
Ramme 1
Alle kreftpasienter bør få følgende orale forhold vurdert og/eller behandlet før kreftbehandling påbegynnes (4). Både klinisk og røntgenologisk undersøkelse er nødvendig
Karies (mengde/alvorlighetsgrad)
Tenner som krever endodontisk terapi
Periodontal sykdom
Periapikal infeksjon og annen skade i kjevene
Sykdomstilstander relatert til visdomstenner (perikoronitt)
Antall tenner som bør ekstraheres
Munnhygiene (instruksjon og oppfølging)
Spyttkjerteldysfunksjon (informasjon/tiltak)
Slimhinnelidelser
Traumeinduserende tann- og fyllingskanter
Temporomandibuær dysfunksjon
Nødvendig tid for stabilisering av oral sykdom (helst 2 – 3 uker)
Det er velkjent at strålebehandling mot kreft i hode-hals-regionen gir orale komplikasjoner både på kort og på lang sikt (Figur 1). Foreløpig er det ingen konsensus når det gjelder langtidseffekter etter cytostatikabehandling. Litteraturen på området er sparsom, men det er hevdet at salivas kvalitet og kvantitet kan være påvirket i lang tid etter endt cytostatikaterapi (9).
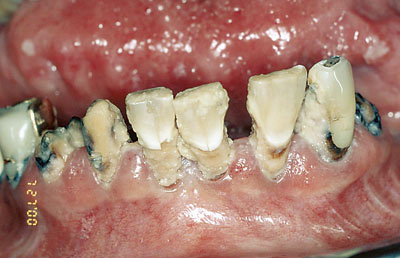
Figur 1. Stråleindusert alvorlig karies i samtlige gjenværende tenner i et neglisjert tannsett trekvart år etter endt stråling til 70 Gy.
Strålebehandling mot spyttkjertler og munnhule utløser betinget pliktmessig stønad til tannbehandling etter folketrygdloven § 5-6. Andre kreftpasienter med økt tannbehandlingsbehov etter behandling med cytostatika har hittil i liten grad fått støtte fra trygden. Rikstrygdeverket har nå, etter påtrykk fra odontologiske fagmiljøer, gitt mulighet for bidrag til tannbehandling ifølge § 5-22b for pasienter med munntørrhet og infeksjoner i munnhulen relatert til cytostatikabehandling mot kreft.
Systematiske munnpleieprotokoller anbefales for å opprettholde adekvat munnhelse og for å redusere orale komplikasjoner på kort og på lang sikt (10). Mangel på kunnskap hos helsepersonell og mangel på tannhelsepersonell tilknyttet onkologiske avdelinger er viktige barrierer for implementering av orale helsestandarder, og dette kan være årsak til dårlig informasjon til kreftpasienter og deres pleiere og pårørende (11). Helsepersonell som er med i behandlingen av kreftpasienter, bør i utdanningen få trening i munnhuleundersøkelse og få innprentet betydningen av å opprettholde en optimal munnhelse under og etter kreftbehandling.
Oral mukositt
Mukositt er en av de viktigste orale komplikasjoner ved kreftbehandling og defineres som en inflammasjonsliknende prosess i oral mucosa forårsaket av cytostatika og ioniserende stråling (4). Andre begreper som ofte benyttes, er epitelitt og stomatitt. Epitelitt er ifølge nyere forståelse misvisende, da det er økende dokumentasjon for at alle celler og lag i oral mucosa bidrar til prosessen. Stomatitt refererer til enhver inflammatorisk tilstand i mucosa, betegnelsen er ikke årsaksspesifikk.
Frekvens og alvorlighetsgrad varierer med cytostatikaregime og strålefelt og stråledose. Henholdvis 14 – 40 % og 90 – 100 % av disse pasientene utvikler mukositt (5, 12). Smerter i munnhulen gir dårligere livskvalitet for pasienten, og vedkommende kan få problemer med å spise, svelge og snakke og er disponert for alvorlige infeksjoner, inkludert sepsis.
De mange skåringssystemer for mukositt har gjort det vanskelige å sammenlikne ulike studier relatert til tiltak og forebygging av tilstanden. Det er nylig utviklet kunnskapsbaserte retningslinjer for forebygging, evaluering og behandling av oral og gastrointestinal mukositt assosiert med kreftbehandling (10). Disse skal revideres hvert tredje år. Få intervensjoner har vist seg effektive i forebygging av mukositt, og det finnes foreløpig ingen internasjonal akseptert behandling. En spesifikk vekstfaktor, rekombinant human keratinocyttvekstfaktor, synes i dag å være det mest lovende agens (5).
Infeksjoner
Det er antatt at munnhulens mikroflora består av ca. 800 bakteriearter. Forandringer i denne mikrofloraen ved kreftbehandling kan føre til lokale og systemiske infeksjoner. Cytostatikabehandling og lokal stråling ødelegger munnslimhinnens forsvarsmekanisme ved å indusere epitelial atrofi, ulcerasjoner, redusert salivasekresjon og granulocytopeni. Redusert barrierefunksjon og tilhelingsevne fører til proliferasjon av mikrobiell biofilm på mucosa, invasjon av mikroorganismer og økt risiko for systemiske infeksjoner, som kan være livstruende (13).
Sopp (Candida albicans), bakterier (gramnegative anaerober) og virus (herpes simplex-virus type 1) kan være primær årsak til slimhinneulcerasjoner eller kan sekundært invadere en allerede ikke-infeksiøs slimhinneforandring. Forandringer i den orale mikroflora kan i tillegg fremme oppvekst av spesielt kariogene organismer, blant annet Streptococcus mutans, som er ansett å være den viktigste mikroorganismen involvert i utviklingen av karies (9). Forebygging omfatter blant annet eliminasjon av traumeinduserende agenser, reduksjon i patologisk overvekst av mikroorganismer og normalisering av den orale mikroflora.
Spyttkjerteldysfunskjon
Dette er et problem hos kreftpasienter som blir behandlet med cytostatika og/eller stråling der spyttkjertlene er med i strålefeltet. Både salivas volum og sekresjonshastighet (kvantitet) og salivas sammensetning (kvalitet) kan bli påvirket. Over 250 medikamenter, blant dem cytostatika, kan gi spyttkjerteldysfunksjon. Medikamentelt indusert spyttkjerteldysfunksjon er vanligvis reversibel, men det er uklart om enkelte cytostatika kan gi irreversible spyttkjertelforandringer som påvirker ikke bare salivas kvantitet, men også kvalitet (9).
Munntørrhet innbefatter to nærstående medisinske begreper: xerostomi og hyposalivasjon. Xerostomi er den subjektive følelsen av munntørrhet, hyposalivasjon er en objektiv reduksjon i salivasekresjon som følge av spyttkjerteldysfunksjon. Det kan påvises ved sialometri, der salivasekresjonen måles i hvile og i stimulert tilstand (14). I hviletilstand står submandibulariskjertlene, som er av blandet, men hovedsakelig serøs type, for to tredeler av salivavolumet. Sublingualiskjertlene, som hovedsakelig er av mukøs type, står for noen få prosent av salivaproduksjonen. Parotiskjertlene er av serøs type og står for mer enn to tredeler av salivavolumet i stimulert tilstand. De små spyttkjertlene finnes flere steder i oral mucosa og produserer ca. 10 % av den totale salivamengden. Sekresjonen er kontinuerlig og mucinrik og har stor betydning for smøring og beskyttelse av munnslimhinnene (9).
Stråling i tumoricide doser der spyttkjertler inngår i strålefeltet, gir irreversible skader som påvirker både salivas kvantitet og kvalitet, avhengig av hvilke spyttkjertler som affiseres. Permanent xerostomi er den viktigste langtidseffekt hos strålebehandlede pasienter med hode-hals-kreft. Det gir redusert livskvalitet (15).
Munntørrhet ble i en pilotstudie rapportert hos 53 av 62 kreftpasienter (uten hode-hals-kreft) som ble behandlet med cytostatika (Herlofson og medarbeidere. Oral morbidity in cancer patients. A pilot study. 7th Biennal Congress European Association of Oral Medicine, Berlin, 2004). Pasientene rangerte munntørrhet som sitt største problem uken før registreringen på en visuell analog skala (Edmonton symptom assessment system; ESAS) (16) – over smerter totalt, slapphet, kvalme, obstipasjon, matlyst, angst, uro og depresjon.
Spyttkjerteldysfunksjon kan gi munntørrhet, tørre og sprukne lepper, svie og brenning i slimhinnene, angulær cheilitt, proteseproblemer, smaksforstyrrelser, vanskeligheter med å tygge, svelge og snakke, karies (Figur 1), progrediering av periodontal sykdom og infeksjoner, spesielt candidiasis (9). Spyttkjerteldysfunksjon kan forverre og forlenge prosessen ved mukositt og redusere munnhulens bufferkapasitet, noe som igjen øker risikoen for karies og progrediering av periodontal sykdom. Mangel på antimikrobielle proteiner som normalt skal finnes i saliva, fører også til ytterligere risiko for utvikling av karies (8).
Osteoradionekrose
Osteoradionekrose er en fryktet komplikasjon etter strålebehandling. På grunn av skade i cellulær aktivitet og kollagendanning blir beinvevet hypoksisk, hypocellulært og hypovaskularisert (6). Mandibelen er spesielt utsatt. Prevalensen varierer mellom 2,6 % og 44 %, avhengig av stråledose, type behandling (med eller uten brakyterapi) og pasientseleksjon. Osteoradionekrose defineres som radiologisk bekreftet beinnekrose i strålefeltet, tumorresidiv er ekskludert (17). Dårlig munnhygiene og patologiske tilstander i tenner, slimhinner og kjever synes å være de viktigste risikofaktorer i å trigge utviklingen av osteoradionekrose – ved siden av stråledosen selv.
Behandling (konserverende, hyperbaroksygenering) av osteoradionekrose er basert på flere faktorer, slik som utbredelse, alvorlighetsgrad og smerte. Da de fleste tilfeller av intraoral osteoradionekrose er assosiert med dental sykdom og ekstraksjon av tenner etter endt strålebehandling, er initial eliminering av potensielle patologiske foci i tenner og kjever basis for forebygging (Ramme 1). Til tross for slike forebyggende tiltak kan man forvente en insidens av spontan eller idiopatisk osteoradionekrose på ca. 3 %.
Nyere studier indikerer en assosiasjon mellom mikroorganismer, spesielt stavbakterier, og osteoradionekrose (18, 19). Flere arter er funnet i dype beinprøver, ikke bare som overflatekontaminanter. Det forslås en revisjon av tidligere antatt patofysiologi ved osteoradionekrose som også omfatter muligheten av infeksiøs etiologi.
Osteonekrose
Det er velkjent at bisfosfonater er meget effektive i å redusere symptomer og komplikasjoner ved metastatisk beinsykdom hos pasienter med brystkreft, prostatakreft og multiple myelomer (20). Imidlertid er det i den senere tid rapportert osteonekrose i kjevene (avaskulær beinnekrose) som mulig komplikasjon/bivirkning i forbindelse med slik bisfosfonatterapi (21, 22). De fleste rapporterte tilfeller er assosiert med de høypotente bisfosfonatene pamidronsyre og zoledronsyre og ekstraksjon av tenner under slik behandling (Figur 2). Av 36 tilfeller av osteonekrose var 28 (78 %) initiert av tannekstraksjoner (21). Av de resterende «spontane» beineksponeringene synes tynn munnslimhinne å ha betydning, da de fleste tilfellene oppstod på lingualsiden posteriort i mandibelen, et sted med tynn mucosa. Vi har hittil registrert fem tilfeller av bisfosfonatassosiert ostenekrose, alle i underkjeven, fire etter tannekstraksjoner og ett etter oralkirurgisk inngrep.
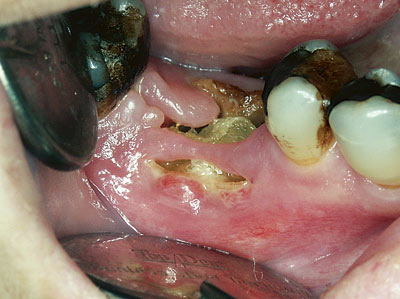
Figur 2. Osteonekrose i mandibelen etter ekstraksjon av tann 46 hos brystkreftpasient med skjelettmetastaser under behandling med bisfosfonatpreparat.
Kjevene er den eneste del av skjelettet som er eksponert for det eksterne miljø via tannkjøttlommer rundt tennene. Dette er foreslått som årsak til at kjevene synes å være mest utsatt for bisfosfonatrelatert osteonekrose (21). Patologiske tilstander i tenner, tannkjøtt og kjever øker kravet til hastighet på beinvevsomsetningen, som ved bisfosfonatterapi er kompromittert. Det synes som om osteonekrose utvikles ved at kjevebeinet eksponeres for munnhulens mikroflora uten å kunne tilheles – beinet blir infisert, pasienten får smerter og større eller mindre beinområder blottlegges. Da det så langt ikke finnes noen effektiv behandling, er pasientene avhengig av periodevis regional debridering og infeksjonskontroll med antibiotika (21).
Det er utarbeidet nye preparatomtaler vedrørende sammenheng mellom høypotente bisfosfonater og utvikling av osteonekrose i kjevene (23). Anbefalinger om forebygging, diagnose og behandling er utarbeidet av et ekspertpanel i USA (24). Inntil videre anbefaler panelet forebyggende tannbehandling før initiering av bisfosfonatterapi med henblikk på de samme punkter som er nevnt i ramme 1. Det er uklart om det bare er intravenøst administrerte bisfosfonater som kan gi denne komplikasjonen.
Helsepersonell, spesielt onkologer, må være oppmerksomme på faren for osteonekrose, da et økende antall pasienter har behov for bisfosfonatterapi.
Konklusjon
Orale komplikasjoner ved cytostatika- og strålebehandling er mange, og flere synes å komme til etter som nye og intensive behandlingsregimer utvikles. Dette fordrer et multidisiplinært samarbeid der odontologisk helsepersonell bør være en naturlig del av det onkologiske team. Det er nødvendig med økt kunnskap, informasjon og utdanning om orale problemstillinger ved kreft og kreftbehandling for oppnå en optimal kreftomsorg.
Hovedbudskap | |
|---|---|
• |
Cytostatikabehandling eller stråling mot hode-hals-regionen kan medføre akutte og kroniske bivirkninger i munnhulen |
• |
Patologiske prosesser i tenner, slimhinner og kjever bør elimineres før behandlingsstart |
• |
Bisfosfonater i kreftbehandling er assosiert med risiko for utvikling av osteonekrose i kjevene |
• |
Tannhelsepersonell bør være involvert i behandlingen av kreftpasienter |
• |
Kunnskap om munnhelse bør inn i utdanningen av helsepersonell som behandler kreftpasienter |
Litteratur
1. Öhrn K. Oral health and experience of oral care among patients during radio- or chemotherapy. Doktoravhandling. Uppsala: University of Uppsala, 2001.
2. Elting LS, Cooksley C, Chambers M et al. The burdens of cancer therapy. Am Cancer Soc 2003; 98: 1531 – 9.
3. Toth BB, Chambers MS, Fleming TJ et al. Minimizing oral complications of cancer treatment. Oncology 1995; 9: 851 – 66.
4. National Cancer Institute. Oral complications of chemotherapy and head/neck radiation. www.cancer.gov (9.8.2005).
5. Saadeh CE. Chemotherapy- and radiotherapy-induced oral mucositis: review of preventive strategies and treatment. Pharmacotherapy 2005; 25: 540 – 54.
6. Støre G. Mandibular osteoradionecrosis. Doktoravhandling. Oslo: Universitetet i Oslo, 2000.
7. Sonis ST. Mucositis as a biological prosess: a new hypothesis for the development of chemotherapy-induced stomatotoxicity. Oral Oncol 1998; 34: 39 – 43.
8. Jankovic LJ, Jelic S, Filipovi-Ljekovic et al. Salivary immunoglobulins in cancer patients with chemotherapy-related oral mucosa damage. Oral Oncol Eur J Cancer 1995; 3; 160 – 5.
9. Jensen SB, Pedersen AM, Reibel J et al. Xerostomia and hypofunction of the salivary glands in cancer therapy. Support Care Cancer 2003; 11: 207 – 25.
10. Rubenstein EB, Peterson DE, Schubert M et al. Clinical practice guidelines for the prevention and treatment of cancer therapy-induced oral and gastrointestinal mucositis. Cancer 2004; 100 (suppl 9): 2026 – 46.
11. Daniel BT, Damato KL, Johnson J. Educational issues in oral care. Semin Oncol Nurs 2004; 20: 48 – 52.
12. Herlofson BB, Norman-Pedersen K, Redfors M et al. Oral mucosal side effects of cytotoxic chemotherapy of testicular cancer. Eur J Oral Sci 1997; 105: 523 – 6.
13. Nagy K, Szöke I, Sonkodi I et al. Inhibition of microflora associated with oral malignancy. Oral Oncology 2000; 36: 32 – 6.
14. Sreebny LM. Saliva in health and disease: an appraisal and update. Int Dent J 2000; 50: 140 – 61.
15. Hammerlid E, Bjordal K, Ahlner-Elmqvist M et al. A prospective study of quality of life in head and neck cancer patients. Part 1: At diagnosis. Laryngoscope 2001; 111: 669 – 80.
16. Bruera E, Kuehn N, Miller MJ et al. The Edmonton symptom assessment system (ESAS): A simple method of assessment of palliative care patient. J Palliat Care 1991; 7: 6 – 9.
17. Store G, Boysen M. Mandibular osteoradionecrosis: clinical behaviour and diagnostic aspects. Clin Otolaryngol 2000; 25: 378 – 84.
18. Store G, Eribe ER, Olsen I. DNA-DNA hybridization demonstrates multiple bacteria in osteoradionecrosis. Int J Oral Maxillofac Surg 2005; 32: 193 – 6.
19. Store G, Olsen I. Scanning and transmission electron microscopy demonstrates bacteria in osteoradionnecrosis. Int J Oral Maxillofac Surg 2005; 34: 777 – 81.
20. Perry CM, Figgitt DP. Zoledronic acid: a review in its use in patients with advanced cancer. Drugs 2004; 64: 1197 – 211.
21. Marx RE. Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic. J Oral Maxillofac Surg 2003; 61: 1115 – 8.
22. Ruggiero SL, Mehrotra B, Rosenberg TJ et al. Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 2004; 62: 527 – 34.
23. Changes to the precautions and post-marketing experience sections of Aredia (pamidronate disodium) injection and Zometa (zoledronic acid) injection prescribing information related to osteonecrosis of the jaw. September 24, 2004 (pakningsvedlegg) http://www.novartis.com (16.6.2005).
24. Ruggiero S, Gralow J, Marx R et al. Practical guidelines for the prevention, diagnosis, and treatment of osteonecrosis of the jaw in patients with cancer. J Oncology Practice 2006; 2: 7 – 14.
Adresse: Det odontologiske fakultet, Avdeling for oral kirurgi og oral medisin, Universitetet i Oslo, Postboks 1109 Blindern, 0317 Oslo. E-post: brokstad@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.