Hva nye teknikker har lært oss om normalfloraen i munnen
Forfattere
tannlege, postdoktor, ph.d. Institutt for oral biologi, Universitetet i Oslo
professor. Department of Oral and Developmental Biology, Harvard School of Dental Medicine, Boston. Senior investigator, Department of Molecular Genetics, Forsyth Institute, Boston, MA, USA. Adjunct professor, Institutt for oral biologi, Universitetet i Oslo
professor. Department of Oral and Developmental Biology, Harvard School of Dental Medicine, Boston. Senior investigator, Department of Molecular Genetics, Forsyth Institute, Boston, MA, USA. Adjunct professor, Institutt for oral biologi, Universitetet i Oslo
dr.odont., professor, forskningsdekan. Institutt for oral biologi, Universitetet i Oslo
Artikkelen er basert på artikkel tidligere publisert i J Clin Microbiol 2005; 43: 5721 – 32. Artikkelen var i 2006 blant de mest etterspurte i samme tidsskrift.
I de siste tiårenes forskning er betydningen av mikrofloraen ved karies og periodontitt viet mye oppmerksomhet. Det er foreslått at enkelte bakterier er viktigere enn andre når det gjelder å utløse disse sykdommene. I denne diskusjonen har man glemt normalfloraen. Det vil være vanskelig å forstå etiologi og patogenese ved disse sykdommene dersom man ikke på forhånd kjenner normalfloraen. Man synes også, i bestrebelsene på å avdekke sentrale agens, å ha glemt at bare 50 % av mikrofloraen i munnhulen kan dyrkes. Det er ingen grunn til å tro at den ikke- dyrkbare delen av mikrofloraen er mindre viktig for karies og periodontitt enn den dyrkbare. Denne oversikten tar for seg gjeldende teorier for plakk (biofilm) som utløser karies og periodontitt.
Molekylærbiologiske metoder som polymerase kjedereaksjon (PCR), kloning og sekvensering (16S rDNA og 18S rDNA) kan avdekke hele mikrofloraen i munnhulen (bakterier og sopp), også den delen som ikke kan dyrkes.
Med utgangspunkt i egne forsøk viser vi hvorledes normalfloraen i munnhulen varierer fra habitat til habitat, og at hele 60 % av denne ikke kan dyrkes. Oversikten viser at normalfloraen i munnhulen er svært rik og inneholder en rekke nye bakterier som aldri tidligere er blitt beskrevet.
Munnhulen består av en rekke forskjellige «sites» (habitater) og overflater. Hver av dem er dekket av biofilm bestående av komplekse mikrobielle samfunn. Noen av bakteriene som utgjør denne biofilmen, er blitt assosiert med klassiske orale sykdommer som karies og periodontitt. Karies er den vanligste kroniske sykdom blant barn i hele verden (1), og det er anslått at minst 35 % av den voksne befolkningen i USA mellom 30 og 90 år har periodontitt (2). Videre er orale bakterier påvist i forbindelse med systemiske sykdommer som bakteriell endokarditt (3), aspirasjonspneumoni (4), osteomyelitt (5), lav fødselsvekt blant for tidlig fødte (6) og med kardiovaskulære sykdommer (7). Overraskende nok finnes det svært lite kunnskap om mikrofloraen i en frisk munnhule. Det vil være vanskelig å forstå patogenesen til sykdommer forårsaket av mikroorganismer hvis vi ikke vet hva som kjennetegner friske forhold.
Oral mikrobiell økologi og plakkhypoteser
I 1971 påpekte Socransky og Manganiello at det var lite informasjon om etablering og utvikling av mikrofloraen i munnhulen. Forfatterne tok i bruk økologiske prinsipper for å forstå etablering og kontroll av plakk (8). På denne tiden var det enighet om at mikroorganismer må å feste seg til en overflate for å overleve i munnen. Fra flere publikasjoner kunne man lese at dietten til verten påvirker mikrobiell sammensetning og mengden av plakk som produseres (9). Socransky og Manganiello viste imidlertid i sine studier at mikrofloraen er rik selv hos personer som ernæres ved intubasjon (8). Morhart og Fitzgerald (10) så på næringsfaktorer som avgjørende for oral økologi og konkluderte med at endogene faktorer som gingivalvæske og saliva, spiller en dominerende rolle. I 1984 pastulerte Socransky at det finnes mikrobielle elementer i plakk som ikke er skadelige for den orale helse, og at ikke alle mikroorganismer opptrer hos alle mennesker (11).
Plakkhypoteser
Det finnes flere hypoteser i litteraturen som forsøker å forklare forholdet mellom mikrobielt plakk og vert. To hovedhypoteser benyttes for å forklare den rollen bakterier i plakk spiller ved initiering og utvikling av sykdom. Den uspesifikke plakkhypotesen (12) hevder at sykdom er et resultat av den totale aktiviteten i plakk. Alle bakteriene her er tenkt å ha noen av virulensfaktorene som forårsaker sykdom. Ut fra denne hypotesen trodde man at total plakk-kontroll var nødvendig for å motvirke sykdom. I motsetning til denne hypotesen hevder den spesifikke plakkhypotesen (13) at visse bakteriearter i plakk er spesielt skadelige for orale strukturer og vev. Slike bakterier forårsaker spesifikke orale sykdommer. I denne hypotesen anses normalfloraen å representere friske forhold uten dominans av bakterier assosiert med sykdom (13). Den tredje hypotesen, den økologiske plakkhypotesen (14), foreslår at forandringer i viktige miljøfaktorer som pH, O2-metning, red-okspotensial og antimikrobielle produkter vil gi en forandring i balansen til mikrofloraen i et spesifikt habitat slik at sykdom initieres.
Mikrobiell homeostase
Plakk i munnhulen er kontinuerlig eksponert for mindre miljørelaterte forandringer, og motstanden (mikrobiell homeostase) i plakk mot disse forandringene er avgjørende for resistens mot utvikling av sykdom på stedet. Mikrobiell homeostase og koloniseringsresistens mot nye bakterier utenfra styrker symbiosen mellom verten og mikrofloraen. Man bør unngå å forstyrre denne likevekten ved å eliminere den normale biofilm på stedet. Videre vil disse faktorene hindre habitater fra å komme i ubalanse og utvikle sykdom. Ved utvikling av sykdom vil sammensetningen av mikroorganismer i plakk forandre seg. Patogene bakterier vil formere seg på bekostning av bakterier som er assosiert med friske forhold. Den økologiske plakkhypotesen representerer en dynamisk modell som forklarer utvikling fra normal mikroflora til en flora assosiert med sykdom. Den postulerer at patogene mikroorganismer kan være tilstede i friske områder, men på et nivå som er for lavt til å forårsake sykdom (15).
Fokus på mikrobielle samfunn fremfor enkeltbakterier
Forståelsen av sykdommer forårsaket av mikroorganismer har forandret seg fra et fokus på enkelte mikroorganismer assosiert med spesifikke sykdommer til fokus på dynamiske mikrobielle samfunn som er under kontinuerlig forandring. Miljøet i det enkelte habitat vil diktere hvilke egenskaper som kreves av den enkelte mikrobe for å hevde seg i konkurranse med et hundretalls av andre mikroorganismer. Med dagens forståelse synes økologiske forandringer i ett habitat å forandre den totale mikrobielle sammensetning. Forståelsen av økologiske mikrobielle samfunn er sentral i fremtidig behandling og forebyggende arbeid. Valg av antibiotikum i klinikken er som kjent basert på hvilke mikroorganismer som er identifisert ved sykdom. Ny kunnskap om hvilke mikrober som er til stede vil gi oss et bedre grunnlag for å velge riktig antibiotikum.
DNA-sekvensering
Med utviklingen av DNA-sekvensering er det blitt mulig å identifisere mange former for organismer. Innen mikrobiologien førte det til oppdagelsen av komplekse mikrobielle samfunn. Tradisjonelle diagnostiske metoder basert på dyrkning viser seg å ha store begrensninger når det gjelder påvisning av alle de mikrobene som er til stede i en biofilm. Mikroskopiske undersøkelser påviser mikrober, men identifiserer ikke hvilke arter som er til stede. Tradisjonelt har dyrkning blitt benyttet til dette formålet. For å imøtekomme kravene til vekst innen komplekse mikrobielle samfunn må en rekke miljøfaktorer oppfylles. Krav til temperatur, pH, næringsstoffer, væskeinnhold, oksygen og karbondioksid kan oppfylles for mange bakterier med ulike dyrkningsmedier, men ikke for alle. Så langt har bakterier som ikke lar seg dyrke kun blitt observert i mikroskopet.
Nye molekylærbiologiske teknikker
Nye molekylærbiologiske teknikker gjør det mulig å påvise tilstedeværelse av bakterier ved hjelp av deres DNA uten dyrkning i laboratoriene. For identifisering av bakterier og sopp er genene 16S rDNA og 18S rDNA benyttet. 16S og 18S rDNA er de mest benyttede komponentene fra translasjonsapparatet for proteinproduksjon i henholdsvis bakterier og sopp. Alle bakterier og sopp har disse genene, og de er lange nok (1500/1800 basepar) til å identifisere spesifikke arter. De er også korte nok til å tillate enkel sekvensering. Disse teknikkene er uavhengig av dyrkning, slik at det ikke finnes begrensninger relatert til kompleksiteten (antall mikroorganismer til stede) av populasjonene som undersøkes. Ved hjelp av disse teknikkene er det anslått at kun 50 % av bakteriene i munnhulen kan påvises ved hjelp av dyrkning. Dette innebærer at vi per i dag har lite kunnskap om den resterende halvdelen av bakteriefloraen i munnhulen. Det finnes ingen grunn til å tro at ikke den andre halvdelen av bakteriefloraen er involvert i sykdomsutvikling. Basert på molekylære teknikker og sekvensanalyser av mer enn 17 000 16S rDNA-kloner fra pasientprøver, har vi nå identifisert 771 bakteriearter fra ulike tilstander i munnhulen. Av disse lar 60 % seg ikke dyrke i laboratoriene (17). Identifisering av alle medlemmene i mikrobielle samfunn som representerer både friske forhold og sykdom er viktig i forståelsen av etiologi og patogenese ved infeksiøse sykdommer.
Fylogeni
På basis av DNA-sekvensering kan det produseres fylogenetiske trær som viser hvilke familier ulike arter tilhører (Figur 1B-C, 2B-C, 3). Fylogeni kan defineres som evolusjonen (utviklingen) til arter eller høyere grupper av organismer.
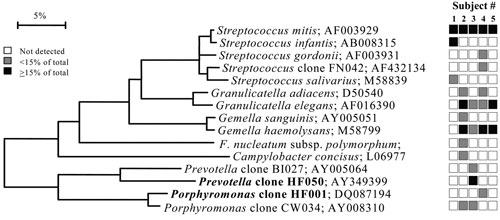
Figur 1. B: Bakterieprofiler ved den anteriore maksillære vestibulum fra klinisk friske individer. Nye bakteriearter identifisert i denne studien indikeres med fet skrift. Distribusjon av bakteriearter/fylotyper blant de fem individene indikeres i boksene til høyre i figuren. Ikke påvist (hvit boks), <15 % av totalt antall kloner (grå boks) og 15 % av totalt antall kloner (sort boks). Lengde og avstand av grener i fylogenetisk tre indikerer genetisk forskjell mellom bakteriearter. Figur gjengitt med tillatelse fra Journal of Clinical Microbiology (18).
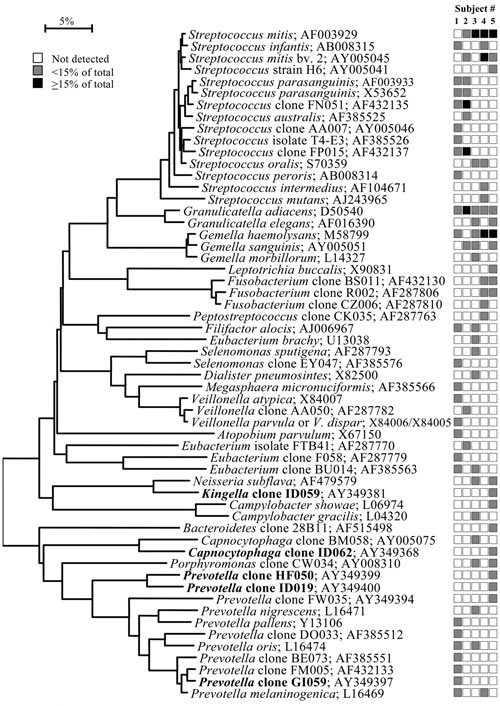
Figur 1. C: Bakterieprofiler ved tonsillene fra klinisk friske individer. Se forklaring Figur 1B (18).
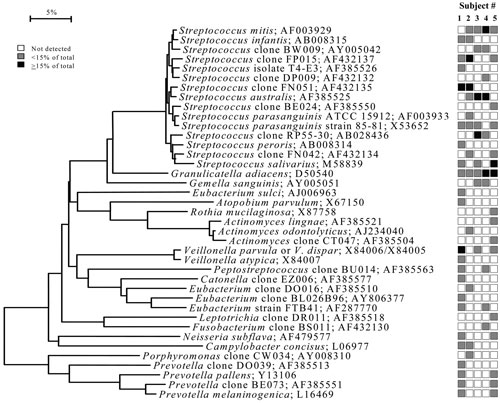
Figur 2. B: Bakterieprofiler ved dorsum av tungen fra klinisk friske individer. Se forklaring Figur 1B (18).

Figur 2. C: Bakterieprofiler fra lateralt på tungen fra klinisk friske individer. Se forklaring Figur 1B (18).
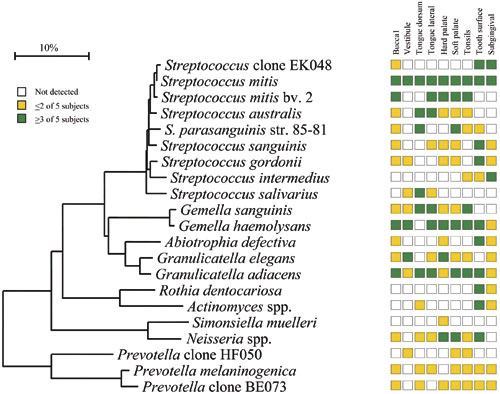
Figur 3. Habitatspesifisitet for dominerende bakterier i klinisk friske munnhuler. Ikke påvist (hvit boks), 15 % av totalt antall kloner blant <2 av 5 individer (gul boks) og 15 % av totalt antall kloner blant 3 av 5 individer (grønn boks). Figur gjengitt med tillatelse fra Journal of Clinical Microbiology (18).
Munnhulens normalflora
Det har lenge vært kjent at bakterier koloniserer ulike orale overflater. Basert på analyser av 2 589 16S rDNA kloner identifiserte Aas et al. (18) et overraskende stort antall bakteriearter fra klinisk friske munnhuler. Fra ni ulike habitater i munnhulen hos fem individer ble det påvist 141 ulike arter. Blant disse bakteriene var 13 bakteriearter identifisert for første gang, og 60 % av det totale antallet arter lar seg ikke dyrke i laboratorier. Habitatene som ble analysert var lokalisert til dorsum og lateralt på tungen, supra- og sugingivalt, harde og bløte gane, tonsillene, bukkalt og anteriore maksillære vestibyle. Bakterier i fire av de ulike habitatene ble analysert og er presentert i fylogenetiske trær i figurene 1B-C og 2B-C. Figur 1B-C viser to fylogenetiske trær som illustrerer forskjell i antall og hvilke arter av bakterier som er identifisert fra tonsillene og fra den anteriore maksillære vestibulum. Mikrofloraen fra tonsillene (Figur 1A) inneholdt 59 arter totalt og det høyeste antall i studien. Det anteriore maksillære vestibulum (Figur 1A) hadde lavest diversitet av bakteriearter blant alle habitatene som var inkludert. Det var overraskende at kun 3 til 9 bakteriearter ble påvist i denne regionen av munnhulen.
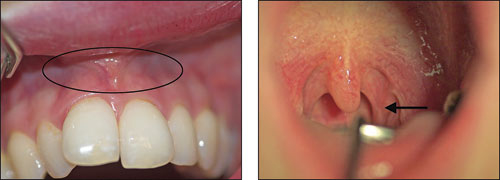
Figur 1. A: Anteriore maksillære vestibyle og tonsillene. (Foto: Morten Enersen).
Hvor mange arter kan et individ med frisk munnhule ha?
Et vanlig spørsmål er hvor mange bakterier et enkelt individ kan ha i en frisk munnhule. Basert på analyser av ni habitater hos fem individer varierte tallet fra 34 til 72 i vår studie.
Forskjeller i mikroflora mellom ulike habitater
En annen observasjon var forskjellene mellom bakteriefloraen på dorsum og lateralt på tungen (Figur 2A-C). Som et eksempel, Streptococcus mitis biovar 2 var representert med et høyt antall lateralt på tungen, men den ble ikke påvist på dorsum av tungen. Streptococcus parasanguinis stamme 85 – 81 var til stede i et høyt antall på dorsum av tungen, men ikke tilstede lateralt på tungen. Forskjellene i mikrofloraen mellom disse habitatene som er lokalisert ved siden av hverandre, var ikke overraskende. De har som kjent ulik funksjon og overflatestruktur. Den laterale siden av tungen har glatt ukeratinisert overflate, og dorsum av tungen har keratinisert og uttalt papillær overflate med underliggende serøse kjertler. Disse anatomiske forskjellene påvirker økologien i habitatene og skaper ulike miljøer som resulterer i forskjellig mikroflora. Av alle de dyrkbare og udyrkbare artene som ble påvist i munnhulen hos klinisk friske individer, var de fra slektene Gemella, Granulicatella, Streptococcus og Veillonella vanligst å finne i samtlige habitater. Streptococcus mitis/Streptococcus pneumonia var de mest dominerende arter som ble påvist og utgjorde så mye som 79 % av alle klonene. Både S. mitis og Streptococcus oralis er assosiert med bakteriell endokarditt, spesielt hos pasienter med kunstige hjerteklaffer (19). I tillegg er de identifisert ved flere anledninger som årsak til infeksjon blant immunkompromitterte pasienter etter vevstransplantasjoner. Granulicatella adiacens var til stede i alle habitatene og er ofte betraktet som en opportunistisk patogen. G. adiacens isolater har i tillegg blitt rapportert fra bakteriemier/sepsis hos pasienter med infeksiøs endokarditt/atheroma (20). Høy mortalitetsratio for endokarditt med G. adiacens har blitt påvist (21). Figur 3 viser en bakterieprofil som gir en god oversikt over normalfloraen i munnhulen samt en oversikt over de mest dominerende artene som ble påvist i de ulike orale habitatene. Noen arter ble kun påvist i bløtvev, Streptococcus sanguinis og Streptococcus australis koloniserte ikke tenner eller den subgingivale lommen. Streptococcus intermedius koloniserte den subgingivale lommen hos alle individene, men var fraværende i de fleste andre habitatene. I kontrast var Neisseria-arter identifisert i alle habitatene med unntak av den subgingivale lommen. Simonsiella muelleri var kun påvist på den harde gane og dermed å regne som en habitatspesifikk bakterie. Av de udyrkbare artene var Prevotella sp. klon HF050 dominerende med så mye som 44 % av klonene som ble analysert fra den anteriore maksillære vestibyle.
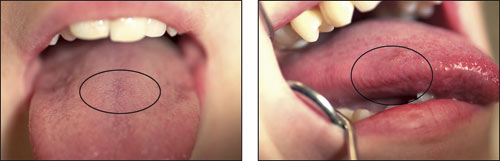
Figur 2. A: Dorsum og lateralt på tungen. (Foto: Morten Enersen).
Konklusjoner
Fra denne studien kan vi kan konkludere med at det finnes en bestemt bakterieflora i en klinisk frisk munnhule. Denne er forskjellig fra bakteriefloraen påvist ved sykdom. Spesifikke bakterier assosiert med periodontitt, Porphyromonas gingivalis, Tannerella forsythia og Treponema denticola, ble ikke påvist i noen av habitatene som ble analysert. Tilsvarende var bakteriefloraen som vanligvis er antatt å forårsake karies, representert ved Streptococcus mutans, Lactobacillus-, Bifidobacterium- og Atopobium-arter, ikke identifisert i noen habitater.
English summary
Aas JA, Paster BJ, Dewhirst FE, Olsen I.
Contribution from new techniques to define the normal bacterial flora of the oral cavity
976 – 82.
The advent of molecular techniques has totally changed our understanding of bacterial diversity. Identification of all members of the oral microflora representing both health and disease is necessary to understand the etiology and progression of infectious diseases. It is important to fully define the human microflora of the healthy oral cavity before we can understand the role of bacteria in oral disease. Analyses of microbial communities using the 16S rDNA approach are culture-independent and there is no limit to the complexity of the population that can be examined. Present studies from the oral cavity have detected more than 700 bacterial species or phylotypes, of which over 50 % have not been cultivated. There is a distinct predominant bacterial flora of the healthy oral cavity that is highly diverse and site- and subject-specific.
Biologi; Mikrobiologi; Plakk; Slimhinne
Hovedbudskap | |
|---|---|
• |
Normalfloraen i munnen er forskjellig fra mikrofloraen assosiert med sykdom |
• |
Normalfloraen er svært rik |
• |
Normalfloraen varierer fra habitat til habitat i munnen |
• |
Hele 60 % av normalfloraen i munnen kan ikke dyrkes |
• |
Normalfloraen i munnen inneholder en rekke bakteriearter som hittil ikke er blitt beskrevet |
Referanser
1. WHO. The world health report 2002. Reducing risks, promoting healthy life. http://www.who.int/whr/2002/en/ (Lest juni 2005).
2. Albandar JM, Brunelle JA, Kingman A. Destructive periodontal disease in adults 30 years of age and older in the United States, 1988 – 1994. J Periodontol 1999; 70: 13 – 29.
3. Berbari EF, Cockerill FR, Steckelberg JM. Infective endocarditis due to unusual or fastidiuos microorganisms. Mayo Clin Proc 1997; 72: 532 – 42.
4. Scannapieco FA. Role of oral bacteria in respiratory infection. J Periodontol 1999; 70: 793 – 802.
5. Dodman T, Robson J, Pincus D. Kingella kingae infections in children. J Paediatr Child Health 2000; 36: 87 – 90.
6. Buduneli N, Baylas H, Buduneli E, Turkoglu O, Kose T, Dahlen G. Periodontal infections and pre-term low birth weight: a case-control study. J Clin Periodontol 2005; 32: 174 – 81.
7. Beck J, Garcia R, Heiss G, Vokonas PS, Offenbacher S. Periodontal disease and cardiovascular disease. J Periodontol 1996; 67: 1123 – 37.
8. Socransky SS, Manganiello SD. The oral microbiota of man from birth to senility. J Periodontol 1971; 42: 485 – 96.
9. Gibbons RJ, Spinell DM. Salivary induced aggregation of plaque bacteria. In: McHugh WD, editor. Dental Plaque. New York: E and S Livingstone Ltd; 1970. p. 207.
10. Morhart RE, Fitzgerald RJ. Nutritional determinants of the ecology of the oral flora. Dent Clin North Am 1976; 20: 473 – 89.
11. Socransky SS. Microbiology of plaque. Compend Contin Educ Dent 1984; 5: 53 – 6.
12. Theilade E. The non-specific theory in microbial etiology of inflammatory periodontal diseases. J Clin Periodontol 1986; 13: 905 – 11.
13. Loesche WJ. The specific plaque hypothesis and the antimicrobial treatment of periodontal disease. Dent Update 1992; 19: 68, 70 – 2,–4.
14. Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res 1994; 8: 263 – 71.
15. Marsh PD. Sugar, fluoride, pH and microbial homeostasis in dental plaque. Proc Finn Dent Soc 1991; 87: 515 – 25.
16. Pace NR, Stahl DA, Lane DJ, Olsen GJ. The analysis of natural microbial populations by ribosomal RNA sequences. Adv Microbial Ecol 1986; 9: 1 – 55.
17. Paster BJ, Olsen I, Aas JA, Dewhirst FE. The breadth of bacterial diversity in the human periodontal pocket and other oral sites. Periodontol 2000 2006; 42: 1 – 8.
18. Aas JA, Paster BJ, Stokes LN, Olsen I, Dewhirst FE. Defining the normal flora of the oral cavity. J Clin Microbiol 2005; 43: 5721 – 32.
19. Douglas CW, Heath J, Hampton KK, Preston FE. Identity of viridans streptococci isolated from cases of infective endocarditis. J Med Microbiol 1993; 39: 179 – 82.
20. Woo PC, Fung AM, Lau SK, Chan BY, Chiu SK, Teng J et al. Granulicatella adiacens and Abiotrophia defectiva bacteraemia characterized by 16S rRNA gene sequencing. J Med Microbiol 2003; 52: 137 – 40.
21. Bouvet A, Acar JF. New bacteriological aspects of infective endocarditis. Eur Heart J 1984; 5: 45 – 8.
Adresse: Jørn A. Aas, Institutt for oral biologi, UiO, postboks 1052 Blindern, 0316 Oslo. E-post: jornaaas@odont.uio.no
Artikkelen har gjennomgått ekstern faglig vurdering.